Bariumoxid (BAO) Struktur, Eigenschaften, Verwendung, Risiken

- 4107
- 641
- Joe Hartwig
Er Bariumoxid Es handelt. Seine chemische Formel ist Bao. Es ist ein weißer kristalline Feststoff und hygroskopisch, dh es absorbiert Feuchtigkeit der Luft, aber damit reagiert es damit damit.
Die schnelle Reaktion von Bariumoxid mit Wasser macht es in chemischen Analyselabors, dh Wasser aus organischen Lösungsmitteln, bei denen es sich um flüssige Verbindungen handelt, die dazu dienen, andere Substanzen aufzulösen.
 Festes Bao -Bariumoxid. Lem [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons.
Festes Bao -Bariumoxid. Lem [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons. Bao verhält sich wie eine starke Base, reagiert daher mit vielen Arten von Säuren. Zum Beispiel leicht mit Kohlendioxid reagieren2 der Luft zur Bildung von Bariumcarbonat Bacchus3.
Es dient bei der Herstellung von Polymeren für Elektrizitätskabel und als Harze.
Bariumoxid (BAO) wird auch in der Keramikindustrie verwendet, um es mit Verglasung abzudecken und sie herzustellen. Es wird auch in Zementmischungen verwendet, um den Kompressionsbeständigkeit des Endprodukts zu erhöhen.
[TOC]
Struktur
Bao -Baar -Oxid wird durch ein Kation BA gebildet2+ und ein Sauerstoffanion oder2-.
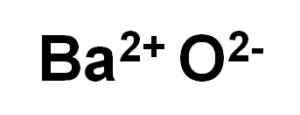 Bao Bariumoxidionen. Autor: Marilú Stea.
Bao Bariumoxidionen. Autor: Marilú Stea. In seinen Kristallen bildet der Bao kubische ionische Netzwerke (in Form eines Würfels) des Natriumchloridtyps.
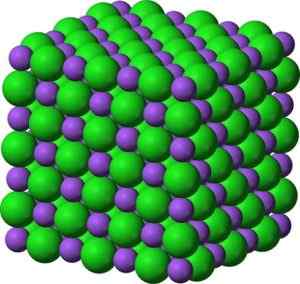 Bao -Bariumoxid -verdrängte kristalline Struktur ähnlich wie Natriumchlorid. Grün: Barium. Blau: Sauerstoff. Benjah-BMM27 (Diskussion · Beiträge) [Public Domain]. Quelle: Wikimedia Commons.
Bao -Bariumoxid -verdrängte kristalline Struktur ähnlich wie Natriumchlorid. Grün: Barium. Blau: Sauerstoff. Benjah-BMM27 (Diskussion · Beiträge) [Public Domain]. Quelle: Wikimedia Commons. Die elektronische Konfiguration des Bariumions lautet: [xe] 6s0 Nun, die beiden Elektronen der 6S -Schicht haben verloren. Diese Konfiguration ist sehr stabil.
Nomenklatur
-Bariumoxid
-Bariummonoxid
Es kann Ihnen dienen: Test: Merkmale, Typen, Beispiele für VerwendungenPhysikalische Eigenschaften
Körperlicher Status
Gelblich weiß kristalline Feststoff.
Molekulargewicht
153,33 g/mol
Schmelzpunkt
1923 ºC
Siedepunkt
Ca. 2000 ºC.
Dichte
5,72 g/cm3
Löslichkeit
Little wasserlöslich: 3,8 g/100 ml bei 20 ºC.
Chemische Eigenschaften
Bario Bao Oxid reagiert schnell2, Dies ist das löslichste Hydroxid zwischen alkalineterischen Metallhydroxiden.
Bao + h2O → Ba (OH)2
Bao ist eine starke Basis. Reagiert exotherm (dh mit Wärmeablösung) mit allen Arten von Säuren.
Mit co2 Bao reagiert zu Bariumcarbonat Bacchus3.
Bao + co2 → Bacchus3
Bao ist hygroskopisch, denn wenn es in die Umwelt erlaubt ist, wird es allmählich mit der Feuchtigkeit der Luft verbunden und bildet BA (OH)2 was mit Kohlendioxid kombiniert wird2 der Luft, um Bariumcarbonat Bacchus zu verleihen3.
Wenn das Bao -Barium -Monoxid in Gegenwart von Luft erhitzt wird, wird es mit Sauerstoff bilden, das Bariumperoxid bao bildet2. Die Reaktion ist reversibel.
2 bao + o2 ⇔ 2 Bao2
In Gegenwart von Wasser kann es mit Aluminium auf die oder mit FIFC -Zn reagieren, die die Oxide oder Hydroxide dieser Metalle bilden und Wasserstoffgas erzeugen2.
Sie können die Polymerisation von organischen Verbindungen initiieren, die polymerisiert werden können, wie z. B. Epoxide.
Risiken
Es kann durch Einnahme giftig sein. Sie sollten sich nicht an die Haut wenden. Es sind irritierende Augen, Haut und Atemwegstrakte. Es kann schädlich für das Nervensystem sein. Es kann einen geringen Kaliumspiegel verursachen, was zu Herz- und Muskelstörungen führt.
Erhalten
Bao -Bariumoxid kann durch Erhitzen des Bario Baco Carbonat erhalten werden3 Mit Kohle. Bao wird gebildet und Kohlenmonoxidgas wird freigesetzt.
Bacchus3 + C → bao + 2 co ↑
Anwendungen
Als Trockenheit organischer Lösungsmittel
Aufgrund seiner Leichtigkeit, mit Wasser zu reagieren.
Es kann Ihnen dienen: Cyanhydsäure: Molekulare Struktur, Eigenschaften, verwendetDer Bao trocknet sehr aktiv um ihn herum, es dauert sehr schnell Feuchtigkeit, wobei die Evolution der Wärme bildet und Bariumhydroxid BA (OH) bildet2 das ist bis zu 1000 ºC stabil. Daher kann der BAO bei hohen Temperaturen verwendet werden.
Es hat auch eine hohe Wasserabsorptionskapazität. Für jedes BAO -Molekül kann man ein Wasser und den BA (OH) absorbieren2 Das resultierende kann auch eine bestimmte Menge Wasser aufnehmen.
Es ist für analytische Chemielabors geeignet. Es ist nicht klebrig.
Es kann in Trockengebern verwendet werden, bei denen es sich um große Glasbehälter mit Deckel handelt, in denen die trockene innere Atmosphäre aufrechterhalten wird. Der Bao hält die Miniatmosphäre des Exsizierers trocken.
 Distintern in einem Labor. Der Trockenmittel -Feststoff wie Bao wird am Boden der Basis platziert. Der ursprüngliche Uploader war Schütze 82 bei English Wikipedia. [CC BY-SA 3.0 (http: // creativecommons.Org/lizenzen/by-sa/3.0/]]. Quelle: Wikimedia Commons.
Distintern in einem Labor. Der Trockenmittel -Feststoff wie Bao wird am Boden der Basis platziert. Der ursprüngliche Uploader war Schütze 82 bei English Wikipedia. [CC BY-SA 3.0 (http: // creativecommons.Org/lizenzen/by-sa/3.0/]]. Quelle: Wikimedia Commons. Diese Austrockner dienen dazu, Substanzen oder Reagenzien zu platzieren und sie so daran zu hindern, Wasser aus der Umwelt zu absorbieren.
Es dient auch dazu, grundlegende Gase wie Ammoniak NH zu trocknen3.
In Download -Lampen
Der BAO wird in den Elektroden der Entladungslampen als Elektronenemitionsmaterial platziert.
Die Entladungslampen werden durch ein Glasrohr, ein Quarz oder ein anderes geeignetes Material gebildet, ein ineres Gas und in den meisten Fällen ein Metalldampf enthalten. Metallic -Dampf kann Natrium oder Quecksilber sein.
 Quecksilberlampe. Dmitry G [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons.
Quecksilberlampe. Dmitry G [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons. Im Röhrchen tritt ein Elektroschock auf, weil er eine positive und eine negative Elektrode hat.
Bao wird in Lampenelektroden platziert. Die Elektronen kollidieren mit den Metalldampfatomen und übertragen Energie.
Es kann Ihnen dienen: CUPRIC OXID (CUO)Beim Übergeben eines elektrischen Stroms durch dieses Gas oder Dampf gibt es sichtbares Licht oder ultraviolette Strahlung (UV).
In der Keramikherstellung
Bao wird in glasierten Keramikbeschichtungszusammensetzungen verwendet.
 Beschichtete Gebäudefassade mit glasierter Keramik. Penny Mayes/glasierte Fassade. Quelle: Wikimedia Commons.
Beschichtete Gebäudefassade mit glasierter Keramik. Penny Mayes/glasierte Fassade. Quelle: Wikimedia Commons. Es wurde jedoch auch als Additiv bei der Vorbereitung von HOG getestet.
BAO verbessert effektiv die mechanischen Eigenschaften und chemischen Resistenz dieser Art von Keramik. Es hat einen starken Einfluss auf die thermischen Eigenschaften und die Zusammensetzung der kristallinen Phase der erhaltenen Materialien.
Bei der Herstellung von Zementmischungen
BAO wurde als Bestandteil des Phosphoaluminatzements getestet.
Diese Art von Zement ist in Meeresumgebungen nützlich, da sie nicht die gleiche Tendenz hat, andere Zementarten zu hydratieren.
Phosphoalumination -Zemente müssen jedoch in ihrer mechanischen Leistung gestärkt werden, um marinen Strömungen und schwimmende Eisstücken im Ozean standzuhalten.
Die Zugabe von BAO zum Phosphoaluminierungszement verändert die Mineralstruktur des Materials, verbessert die Struktur der Poren und erhöht die Druckkraft von Zementpaste erheblich.
Mit anderen Worten, BAO verbessert den Kompressionsbeständigkeit dieser Art von Zement.
 Für Beton mischen. Bao Bariumoxid ist nützlich, um bestimmte Zementeigenschaften zu verbessern. Thamizhpparithi Maari [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons.
Für Beton mischen. Bao Bariumoxid ist nützlich, um bestimmte Zementeigenschaften zu verbessern. Thamizhpparithi Maari [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons. In mehreren Anwendungen
Es wird als Zutat verwendet, um Dentalharzen für die Füllung von Löchern in den Zähnen zu liefern, die von Zahnärzten durchgeführt werden.
Es wird auch als Keimbildungsmittel zur Herstellung von Polyvinyliden -Fluoridpolymeren verwendet, die zur Isolierung von Elektrizitätskabeln verwendet werden.
Verweise
- Partyka, J. et al. (2016). Auswirkung der Zugabe von BAO auf das Sintern von Glasheramikmaterialien von SiOs2-Zum2ENTWEDER3-N / A2OKAY2O-CAO/MGO-System. J Therm Anal Calim (2016) 125: 1095. Link wiederhergestellt.Springer.com.
- Zhang, p. et al. (2019). Wirkung von BAO auf die Mineralstruktur und das Hydratationsverhalten von Phosphoaluminatzement. J Therm Anal Calim (2019) 136: 2319. Link wiederhergestellt.Springer.com.
- ODER.S. Nationalbibliothek für Medizin. (2019). Oxid Barium. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Smith, n.ZU. (2003). Beleuchtung. Prinzip. Im Nachschlagewerk des Elektroingenieurs (Sechzehnte Ausgabe). Von Scientedirect erholt.com.
- Ebnejjad, s. (2003). Fluoropolymerschäume. PVDF -Schaum. In schmelzprozessbarer Fluoroplastik. Von Scientedirect erholt.com.
- Stand, h.S. und McIntyre, l.H. (1930). Bariumoxid als Gläger. Ind. Eng. Chem. Anal. Ed. 1930, 2, 1, 12-15. Aus Pubs geborgen.ACS.Org.
- « Natriumcyanid (NACN) Struktur, Eigenschaften, Risiken, verwendet
- Die 15 besten Lebensmittel, um das Gesäß zu erhöhen (natürlich) »

