Berylliumoxid (Beeo)
- 4914
- 1005
- Tizian Liebich
 Chemische Struktur von Beryloxid
Chemische Struktur von Beryloxid Was ist Beryloxid?
Er Berylliumoxid (BEEO) ist ein Keramikmaterial, das zusätzlich zu seiner hohen Festigkeit und seinem elektrischen Widerstand eine Wärmeleitungskapazität aufweist, die so hoch ist, dass sie einen Teil der Kernreaktoren machen, und sogar die Metalle in dieser letzten Eigenschaft übertreffen.
Zusätzlich zu seiner Nützlichkeit als synthetisches Material kann es auch in der Natur gefunden werden, obwohl es selten ist. Das Management muss sorgfältig durchgeführt werden, da es die Fähigkeit hat, die Gesundheit der Menschen ernsthaft zu beschädigen.
In der modernen Welt wurde beobachtet, wie Wissenschaftler, die mit Technologieunternehmen verbunden sind.
Das Ergebnis davon war die Entdeckung von Substanzen, die uns dank seiner äußerst nützlichen Eigenschaften und ihrer hohen Haltbarkeit die Möglichkeit gegeben haben, im Laufe der Zeit voranzukommen, damit wir unsere Technologie auf höhere Ebenen bringen können.
Chemische Struktur von Beryloxid
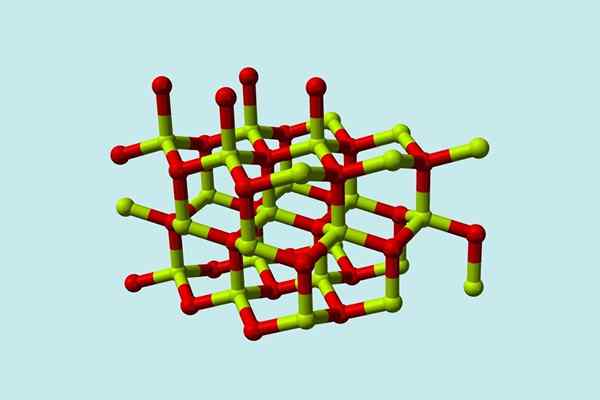
Ein Beryloxidmolekül (auch genannt Berilia) Es besteht aus einem Atom von Beryllium und einem von Sauerstoff, die beide in der tetraedrischen Orientierung koordiniert sind und in hexagonalen kristallinen Strukturen als Wurtzitas namens Wurtzitas kristallisiert werden.
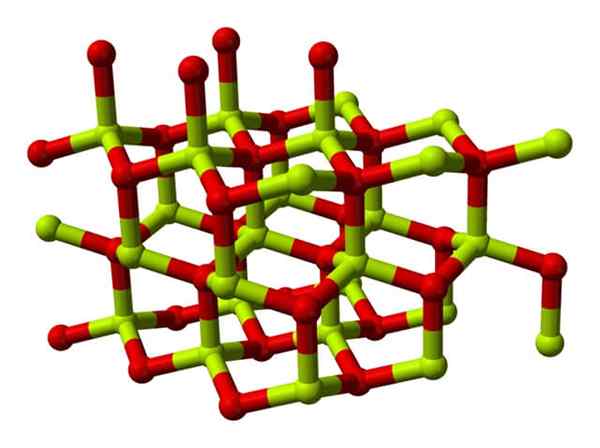 Modell der kristallinen Struktur von Beryloxid. Quelle: Wikimedia Commons
Modell der kristallinen Struktur von Beryloxid. Quelle: Wikimedia Commons Diese Kristalle haben tetraedrische Zentren, die von Be bewohnt sind2+ ICH2-. Bei hohen Temperaturen wird die Struktur von Berylliumoxid zum tetragonalen Typ.
Das Erhalten von Beryloxid wird durch drei Methoden erreicht: Berylcarbon -Kalzinierung, Dehydration von Berylhydroxid oder durch die Zündung von metallischem Beryllium. Das bei hohen Temperaturen gebildete Berylliumoxid ist inert, kann jedoch durch mehrere Verbindungen gelöst werden.
Kann Ihnen dienen: ChlorogensäureBeco3 + Wärme → Biene + Co2 (Kalzinierung)
Sein (oh)2 → Bieneno + H2O (Dehydration)
2 sein + oder2 → 2 Beeo (Zündung)
Schließlich kann Berylliumoxid verdampft werden und in diesem Zustand wird es in Form von Diatommolekülen präsentiert.
Beleryoxideigenschaften
Berylliumoxid wird in Natur.
Auch Verunreinigungen, die während der Produktion gefangen wurden.
Sein Schmelzpunkt befindet sich in 2.507º C, sein Siedepunkt in 3.900 ° C und hat eine Dichte von 3,01 g/cm3.
In ähnlicher Weise ist seine chemische Stabilität erheblich hoch und reagiert nur mit Wasserdampf bei Temperaturen nahe 1.000 ° C und können Kohlenstoffreduktionsprozessen und Angriffe auf geschmolzene Metalle bei hohen Temperaturen standhalten.
Darüber hinaus ist sein mechanischer Widerstand anständig und kann durch Konstruktionen und angemessene Fertigung für kommerzielle Anwendungen verbessert werden.
Elektrische Leitfähigkeit
Berylliumoxid ist ein extrem stabiles Keramikmaterial und hat daher einen ziemlich hohen elektrischen Widerstand, der es zusammen mit Alumina zu einem der besten elektrischen Isoliermaterialien macht.
Aus diesem Grund wird es üblicherweise für hochfrequente spezielle elektrische Geräte verwendet.
Wärmeleitfähigkeit
Berylliumoxid hat einen großen Vorteil in seiner thermischen Leitfähigkeit: Es ist als das zweitbeste Wärmeleitmaterial unter Nicht -Metalen bekannt, das nur von Diamond überwunden wird, ein wesentlich teureres und selteneres Material.
Kann dir dienen: ThiolesIn Bezug.
Aufgrund seiner ausgezeichneten Eigenschaften für Wärmeableitungen war diese Substanz an der Herstellung von feuerfesten Materialien beteiligt.
Optische Eigenschaften
Aufgrund der gleichen kristallinen Eigenschaften wird Berylliumoxid zur Anwendung von transparentem Material auf Ultraviolett in bestimmten flachen Screens und Photovoltaikzellen verwendet.
Ebenso können Kristalle von sehr hoher Qualität auftreten, sodass diese Eigenschaften entsprechend dem verwendeten Herstellungsprozess verbessern.
Gesundheitsrisiken
Berylliumoxid ist eine Verbindung, die mit großer Sorgfalt manipuliert werden muss, da es zuerst krebserregende Eigenschaften aufweist, die mit der kontinuierlichen Inhalation von Pulver oder Dämpfen dieses Materials verbunden sind.
Kleine Partikel in diesen Phasen von Oxid haften an die Lunge und können die Bildung von Tumoren oder eine Krankheit erzeugen, die als Belliose bekannt ist.
Berilaiosis ist eine Krankheit mit einer mittleren Sterblichkeitsrate, die ineffizientes Atmen, Husten, Gewichtsverlust und Fieber sowie die Bildung von Granulomen in der Lunge oder anderen betroffenen Organen erzeugt.
Es besteht auch Gefahr, den Kontakt des Berylliumoxids mit der Haut direkt zu kontaktieren, da es korrosiv und irritierend ist und die Hautoberfläche und die Schleimhäute schädigen kann. Atemstraßen und Hände sollten bei der Arbeit mit diesem Material geschützt werden, insbesondere in ihrer Staubform.
Berylliumoxid verwendet
Die Verwendung von Beryloxid wird hauptsächlich in drei unterteilt: elektronische Anwendungen, Kern und andere.
Kann Ihnen dienen: Was ist der Eristeno?Elektronische Anwendungen
Die Fähigkeit, Wärme auf ein hohes Niveau zu übertragen, und der gute elektrische Widerstand hat Beleriloxid als thermisches Dissipator ein großes Nutzen erfasst.
Die Verwendung in Schaltkreisen in Computern mit hoher Kapazität wurde zusätzlich zu Geräten gezeigt, die mit hohen Stromströmen umgehen.
Berylliumoxid ist für X -Strahlen und Mikrowellen transparent und wird daher neben Antennen, Kommunikationssystemen und Mikrowellenöfen in den Fenstern gegen diese Strahlungsarten verwendet.
Nukleare Anwendungen
Seine Fähigkeit, Neutronen zu moderieren und ihre Struktur unter Strahlungsbomben aufrechtzuerhalten.
Andere Apps
Die geringe Dichte des Berylliumoxids hat Interesse an der Luft- und Raumfahrt- und Militärtechnologieindustrie geweckt, da sie in Motoren für Raketen und Antibalas -Westen eine geringe Gewichtsoption darstellen kann.
Schließlich wurde es kürzlich als feuerfestes Material bei der Verschmelzung von Metallen in Metallurgischen Industrien angewendet.
Verweise
- Pubchem (s.F.). Berylliumoxid. Aus Pubchem erhalten.NCBI.NLM.NIH.Regierung
- Reade (s.F.). Beryllia/Berylliumoxid (Beeo). Reade aus Reade.com
- Forschung, c. (S.F.). Berylliumoxid - Beryllia. Aus Azom erhalten.com
- Dienstleistungen, n. J. (S.F.). Berylliumoxid. Von nj geborgen.Regierung
- Wikipedia (s.F.). Berylliumoxid. Erhalten von in.Wikipedia.Org

