Boroxid (B2O3) Was ist, Struktur, Eigenschaften, verwendet
- 5007
- 545
- Jasmine Kupprion
Er Boroxid o Boranhydrid ist eine anorganische Verbindung, deren chemische Formel b ist2ENTWEDER3. Bor- und Sauerstoffelemente des Blocks P des Periodensystems und noch mehr Köpfe ihrer jeweiligen Gruppen ist der Unterschied in der Elektronegativität zwischen ihnen nicht sehr hoch. Daher wird erwartet, dass das b2ENTWEDER3 kovalent sein.
Das B2ENTWEDER3 Es wird durch Auflösen von Borax in konzentrierter Schwefelsäure in einem Fusionsofen und bei einer Temperatur von 750 ° C hergestellt. Thermisch dehydrierende Borsäure, b (OH)3, bei einer Temperatur von ungefähr 300 ° C; oder es kann auch als Produkt der Diborano -Reaktion (b) gebildet werden2H6) Mit Sauerstoff.
Borooxid kann ein halbtransparentes oder kristallines Glaserschein haben; Letzteres durch Schleifen kann in Staubform erhalten werden.
Obwohl es nicht den ersten Blick zu sehen scheint, wird das B in Betracht gezogen2ENTWEDER3 als eines der komplexesten anorganischen Oxide; Nicht nur aus struktureller Sicht, sondern auch aufgrund der variablen Eigenschaften, die das Glas und die Keramik erwerben, zu denen sie ihrer Matrix hinzugefügt werden.
Borooxidstruktur
Einheit Bo3
Das B2ENTWEDER3 Es ist ein kovalenter Feststoff, also existieren sie theoretisch nicht in seiner Ionen -B -Struktur3+ noch2-, Aber B-O-Links. Boron kann nach Valencias Linktheorie (TEV) nur drei kovalente Verbindungen bilden. In diesem Fall drei B-O-Links. Infolgedessen muss die erwartete Geometrie trigonal sein, bo3.
Das BO -Molekül3 Es sind schlechte Elektronen, insbesondere Sauerstoffatome; Einige von ihnen können jedoch miteinander interagieren, um diesen Mangel zu liefern. So die Dreiecke bo3 Sie werden durch das Teilen einer Sauerstoffbrücke verbunden und im Weltraum als dreieckige Reihen Netzwerke verteilt, wobei ihre Flugzeuge auf unterschiedliche Weise ausgerichtet sind.
Kann Ihnen dienen: ungesättigte LösungKristalline Struktur
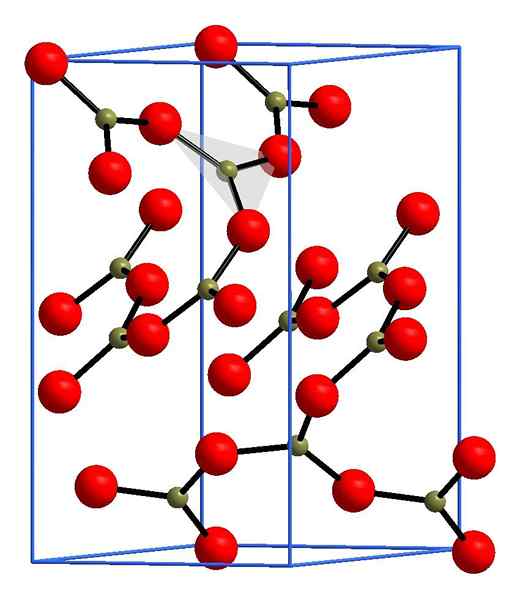
 Borooxidstruktur. ANDIF1, Wikimedia Commons.
Borooxidstruktur. ANDIF1, Wikimedia Commons. Im oberen Bild ein Beispiel für diese Reihen mit dreieckigen Einheiten bo3. Wenn es sorgfältig beobachtet wird, weisen nicht alle Gesichter der Pläne auf den Leser hin, sondern auf die andere Seite. Die Orientierungen dieser Gesichter können dafür verantwortlich sein, wie B definiert wird2ENTWEDER3 bei einer bestimmten Temperatur und einem bestimmten Druck.
Wenn diese Netzwerke ein langes Strukturmuster haben, ist es ein kristalliner Feststoff, der aus seiner Einheitszelle gebaut werden kann. Hier wird gesagt, dass das b2ENTWEDER3 Es hat zwei kristalline Polymorphs: α und β.
Die α-B2ENTWEDER3 Es wird im Umgebungsdruck (1 atm) erzeugt, und es wird gesagt, dass es kinetisch instabil ist; Tatsächlich ist dies einer der Gründe, warum Boroxid wahrscheinlich eine schwierige Kristallisationsverbindung ist.
Das andere Polymorph, β-B2ENTWEDER3, Hohe Drücke werden im GPA -Bereich erhalten; Daher muss seine Dichte größer sein als die von α-B2ENTWEDER3.
Glaskörperstruktur
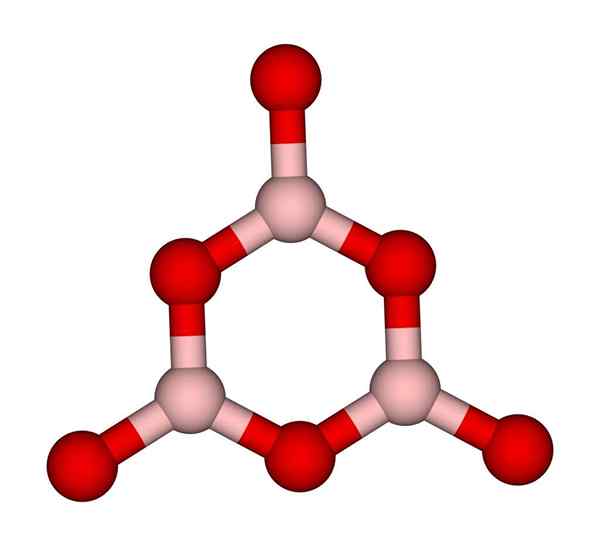 Boroxol -Ring. Ccoil (Talk). Wikimedia Commons.
Boroxol -Ring. Ccoil (Talk). Wikimedia Commons. BO -Netzwerke3 Natürlich neigen dazu, amorphe Strukturen zu übernehmen; Dies sind, der ein Muster fehlt, das die Moleküle oder Ionen im Festen beschreibt. Durch synthese der b2ENTWEDER3 Seine vorherrschende Form ist amorph und nicht die Kristalline; In korrekten Worten: Es ist ein fester Glaskörper als kristalliner.
Es wird dann gesagt, dass das b2ENTWEDER3 Es ist gleitlich oder amorph, wenn Ihre Jungs von Bo3 Sie sind chaotisch. Nicht nur das, sondern ändern auch die Art und Weise, wie sie sich anschließen. Anstatt in einer trigonalen Geometrie zu bestellen, endet ein Boroxol -Ring (überlegenes Bild), um die Forscher zu erstellen (überlegenes Bild).
Kann Ihnen dienen: 20 Beispiele für chemische EnergieBeachten Sie den offensichtlichen Unterschied zwischen dreieckigen und sechseckigen Einheiten. Dreieckige Charakterisierung b2ENTWEDER3 kristalline und sechseckin zu b2ENTWEDER3 Glaskörper. Eine andere Möglichkeit, sich auf diese amorphe Phase zu beziehen, ist Borglas oder mittels einer Formel: G-B2ENTWEDER3 (Das 'g' kommt aus dem Wort glasig in englischer Sprache).
So sind G-B-Netzwerke2ENTWEDER3 Sie bestehen aus Boroxol -Ringen und nicht aus BO -Einheiten3. Allerdings der G-B2ENTWEDER3 kann zu α-B kristallisieren2ENTWEDER3, Dies würde eine Interkonversion von Ringen zu Dreiecken bedeuten und auch den Grad der Kristallisation definieren.
Eigenschaften
Aussehen
Es ist ein farbloser und glasiiger Feststoff. In seiner kristallinen Form ist es weiß.
Molekulare Masse
69.6182 g/mol.
Geschmack
Etwas bitter
Dichte
-Kristalline: 2,46 g/ml.
-Glas: 1,80 g/ml.
Schmelzpunkt
Es hat keinen vollständig definierten Fusionspunkt, da es davon abhängt, wie kristallin oder Glaskörper es ist. Die rein kristalline Form schmilzt auf 450ºC; Die Glaskörperform schmilzt jedoch in einen Temperaturbereich, der von 300 bis 700 ° C abdeckt.
Siedepunkt
Auch hier stimmen die gemeldeten Werte nicht mit diesem Wert überein. Anscheinend flüssiges Boroxid (geschmolzen aus seinen Kristallen oder Glas) kocht bei 1860 ° C.
Stabilität
Es muss trocken gehalten werden, da es Feuchtigkeit absorbiert, um sich in Borsäure zu verwandeln, b (OH)3.
Nomenklatur
Borooxid kann auf andere Weise benannt werden, wie beispielsweise:
-Diboro -Trioxid (Systematische Nomenklatur).
-Boroxid (III) (Stock Nomenklatur).
-Boroxid (traditionelle Nomenklatur).
Anwendungen
Einige der Verwendungen von Boroxid sind:
Boro Trihalogenuros -Synthese
Von b2ENTWEDER3 Kann von Trihalogenuros de Boro, BX, synthetisiert werden3 (X = f, cl y br). Diese Verbindungen sind Lewis -Säuren, und mit ihnen ist es möglich, bestimmte Moleküle Boratome einzuführen, um andere Derivate mit neuen Eigenschaften zu erhalten.
Es kann Ihnen dienen: Polyiatomische Ionen: Liste und ÜbungenInsektizid
Eine feste Mischung mit Borsäure, b2ENTWEDER3-B (OH)3, repräsentiert eine Formel, die als häusliches Insektizid verwendet wird.
Lösungsmittel der Metalloxide: Glasbildung, Keramik und Borlegierungen
Flüssiges Boroxid kann Metalloxide auflösen. Aus dieser resultierenden Mischung, sobald abgekühlt, werden Feststoffe aus Bor und Metallen erhalten.
Abhängig von der Höhe von b2ENTWEDER3 Verwendet sowie die Technik und die Art des Metalloxids, eine reiche Glasvariante (Borosilikate), Keramik (Nitriden und Borcarbide) und Legierungen können erhalten werden (wenn nur Metalle verwendet werden).
Im Allgemeinen erwerben Glas oder Keramiken mehr Widerstand und Stärke und auch eine größere Haltbarkeit. Im Falle von Glas werden sie für optische und Teleskopobjektive sowie für elektronische Geräte verwendet.
Bindemittel
Beim Bau von Stahlgiedrlichen -Öfen werden feuerfeste Ziegel mit Magnesium verwendet. In ihnen wird Boroxid als Bindemittel verwendet, um sie stark zu vermitteln.
Verweise
- Boroxid. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Borix Oxid. 20 Mule Team Borax. Erholt von: Borax.com

