Calciumoxid (CAO)
- 1977
- 263
- Rieke Scheer
Was ist Calciumoxid?
Er Calciumoxid (CAO) ist eine anorganische Verbindung, die Calcium und Sauerstoff in ionischen Formen enthält (nicht mit Calciumperoxid, CAO zu verwechseln, CAO2). Welt als Kalk bekannt, ein Wort, das jede anorganische Verbindung bezeichnet, die Carbonate, Oxide und Calciumhydroxide enthält, zusätzlich zu anderen Metallen wie Silizium, Aluminium und Eisen.
Auf dieses Oxid (oder Kalk) beziehen sich auch umgangssprachlich als lebendig oder kalk, je nachdem, ob es hydratisiert ist oder nicht. Live Lime ist Calciumoxid, während Kalk aus dem Hydroxid ist. Kalkstein (Kalk oder gehärteter Kalk) ist wiederum ein Sedimentgestein, das hauptsächlich aus Calciumcarbonat (Caco) besteht3).
Es ist eine der größten natürlichen Kalziumquellen und bildet den Rohstoff für die Herstellung von Kalziumoxid. Wie wird dieses Oxid erzeugt?? Carbonate sind anfällig für die thermische Zersetzung; Erhitzen von Calciumcarbonaten bei Temperaturen von mehr als 825 ºC führen zu Kalkbildung und Kohlendioxid.
Die vorherige Aussage kann wie folgt beschrieben werden: Caco3(s) → CAO (s) + co2(G). Weil die Erdkruste reich an Kalkstein und Calcit ist und in den Ozeanen und Stränden die Meerschalen (Rohstoffe für die Produktion von Calciumoxid) reichlich vorhanden sind, das Calciumoxid ist ein relativ billiges Reagenz.
Formel
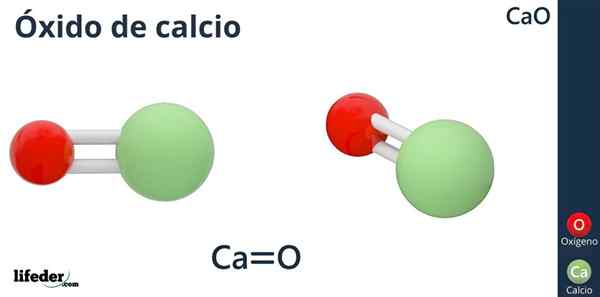
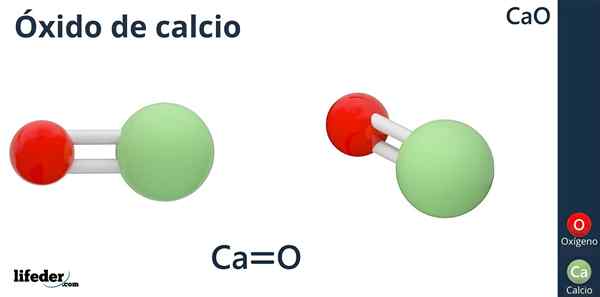
Die chemische Formel von Calciumoxid ist CAO, bei der Kalzium wie das Säureion (Elektronenakzeptor) CA ist2+, und Sauerstoff wie das Basision (Elektronendonor) oder2--.
Warum hat Calcium eine Ladung +2? Weil Kalzium zu Gruppe 2 der Periodenzüchter (SR) gehört. Scholambara) und nur zwei Valenzelektronen zur Verknüpfungsbildung zur Verfügung stehen, was zum Sauerstoffatom ergibt.
Kann Ihnen dienen: Kaliumoxid (K2O)Calciumoxidstruktur
 Kristallstruktur von Calciumoxid
Kristallstruktur von Calciumoxid Die kristalline Struktur (Edelsteinsalztyp) für Calciumoxid wird im oberen Bild dargestellt. Voluminöse rote Kugeln entsprechen CA -Ionen2+ und weiße Kugeln zu Ionen oder2-.
In dieser kubischen kristallinen Anordnung jedes Ion ca2+ ist von sechs Ionen umgeben oder2-, In den oktaedrischen Löchern verschlossen, die große Ionen unter ihnen hinterlassen haben.
Diese Struktur drückt maximal den ionischen Charakter dieses Oxids aus, obwohl der bemerkenswerte Unterschied von Funkeln (die rote Kugel größer als weiß) im Vergleich zum MGO eine schwächere kristalline retikuläre Energie ergibt.
Calciumoxideigenschaften
 Calciumoxid -Aussehen
Calciumoxid -Aussehen Physikalisch handelt es sich um eine kristalline weiße Feststoff, Toilette und starke elektrostatische Wechselwirkungen, die für ihre hohen Fusionspunkte (2572 ° C) und das Kochen (2850 ° C) verantwortlich sind. Darüber hinaus hat es ein Molekulargewicht von 55.958 g/mol und die interessante Eigenschaft, Thermolumineszenz zu sein.
Dies bedeutet, dass ein Stück Calciumoxid, das einer Flamme ausgesetzt ist RAMPENLICHT, oder auf Spanisch Kalziumlicht. Die Ionen ca2+, In Kontakt mit dem Feuer stammen sie aus einer rötlichen Flamme, wie im folgenden Bild zu sehen ist.
 Kalziumlicht oder Rampenlicht
Kalziumlicht oder Rampenlicht Löslichkeit
CAO ist ein Basisoxid, das eine starke Affinität zu Wasser hat, sodass ein solches Ausmaß, das Feuchtigkeit absorbiert (es ist ein hygroskopischer Feststoff), sofort reagiert, um ausgeschaltet oder Calciumhydroxid zu erzeugen:
CAO (s) + h2Oder (l) => ca (OH)2(S)
Diese Reaktion ist aufgrund der Bildung eines Feststoffs mit stärkeren Wechselwirkungen und eines stabileren kristallinen Netzwerks exotherm (sie gibt Wärme auf). Die Reaktion ist jedoch reversibel, wenn die CA (OH) erhitzt wird2, Dehydrieren und Beleuchtung des Kalkes aus; Dann der Kalk "wiedergeboren".
Kann Ihnen dienen: Safranin: Eigenschaften, Verwendung, Techniken, ToxizitätDie resultierende Lösung ist sehr grundlegend, und wenn sie mit Calciumoxid gesättigt ist, erreicht sie einen pH -Wert von 12,8.
Ebenso ist es in Glycerin und in Säure- und zuckerhaltigen Lösungen löslich. Wie ein Grundoxid ist natürlich wirksame Wechselwirkungen mit Säureoxiden (SiO2, Zum2ENTWEDER3 und Glaube2ENTWEDER3, zum Beispiel) in den flüssigen Phasen von ihnen löslich sein. Andererseits ist es in Bio -Alkoholen und Lösungsmitteln unlöslich.
Verwendet/Anwendungen
CAO hat eine riesige unzählige industrielle Verwendung sowie in der Acetylensynthese (CHehnen) bei der Extraktion von Abwasserphosphaten und in der Reaktion mit dem Schwefeldioxid von Erfrischungsgetränken.
Andere Verwendungen von Calciumoxid werden nachstehend beschrieben:
Als Mörtel
Wenn Calciumoxid mit Sand gemischt wird (SiO2) und Wasser, Kuchen mit dem Sand und reagiert langsam mit dem Wasser, um stumpfe Kalk zu bilden. Wiederum co2 Aus der Luft löst sich im Wasser auf und reagiert mit ausgeschaltetem Salz, um Calciumcarbonat zu bilden:
CA (OH)2(s) + co2(g) => Caco3(s) + h2Oder (l)
Der Kako3 Es ist eine widerstandsfähigere und harte Verbindung als der CAO, der dazu führt.
In der Glasproduktion
Der wesentliche Rohstoff für die Glasproduktion sind Siliziumoxide, die mit Kalk, Natriumcarbonat (NA) gemischt werden2CO3) und andere Zusatzstoffe und dann einer Erwärmung ausgesetzt, was zu einem glasigen Feststoff führt. Dieser Feststoff wird anschließend in allen Figuren erhitzt und geblasen.
Im Bergbau
Der stumpfe Kalk nimmt ein größeres Volumen ein als der lebende Kalk aufgrund der Wechselwirkungen durch Wasserstoffbrücken (O-H-O). Diese Eigenschaft wird ausgebeutet, um die Felsen von ihren Anliegen zu brechen.
Kann Ihnen dienen: katalytische HydrierungDies wird erreicht, indem sie mit einer kompakten Mischung aus Kalk und Wasser gefüllt werden, die versiegelt ist, um seine Wärme und expansive Leistung im Felsen zu fokussieren.
Als Silikatentfernermittel
Der CAO verschmilzt mit den Silikaten, um eine zusammenhängende Flüssigkeit zu bilden, die dann aus dem Rohstoff aus einem bestimmten Produkt extrahiert wird.
Zum Beispiel sind Eisenmineralien das Rohmaterial für die Herstellung von metallischem Eisen und Stahl. Diese Mineralien enthalten Silikate, die unerwünschte Verunreinigungen für den Prozess sind und durch die kürzlich beschriebene Methode beseitigt werden.
Calciumoxid -Nanopartikel
Calciumoxid kann als Nanopartikel synthetisiert werden, wobei variierende Calciumnitratkonzentrationen (CA (NO)3)2) und Natriumhydroxid (NaOH) in Lösung.
Diese Partikel sind sphärisch, grundlegend (sowie die makro bis makroskala) und haben viel Oberfläche. Infolgedessen profitieren diese Eigenschaften katalytische Prozesse. Welche? Untersuchungen beantworten derzeit diese Frage.
Diese Nanopartikel wurden verwendet, um substituierte organische Verbindungen - wie aus Pyridin - bei der Formulierung neuer Arzneimittel zur Durchführung chemischer Transformationen wie künstlicher Photosynthese, zur Reinigung von Wasser aus schweren und schädlichen Metallen und als photokatalytische Wirkstoffe zu synthetisieren.
Nanopartikel können in der biologischen Unterstützung wie Papaya- und grünen Teeblättern synthetisiert werden, um sie als antibakterielles Mittel zu verwenden.
Verweise
- Scifun.Org. (2018). Kalk: Calciumoxid. Erholt von: Scifun.Org.
- Wikipedia. (2018). Calciumoxid. Abgerufen von: in.Wikipedia.Org
- Pubchem. (2018). Calciumoxid. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Shiver & Atkins. (2008). Anorganische Chemie. In Die Elemente der Gruppe 2. (vierte Edition., P. 280). Mc Graw Hill.