Chloroxid (III) Eigenschaften, Struktur, verwendet
- 1832
- 342
- Timo Rabenstein
Er Chloroxid (III) Es ist eine anorganische Verbindung, deren chemische Formel Cl ist2ENTWEDER3. Entspricht dem Anhydrid von Chlorsäure HCLO2. Es ist ein dunkelbrauner Feststoff, auch bei Temperaturen unter 0 ° C sehr explosiv und schlecht charakterisiert. Deshalb ist es Interesse für Computerstudien unterliegt.
Chemisch ist es ein kovalentes Oxid, daher gibt es Cl-O-Bindungen und ein diskretes Molekül von CL2ENTWEDER3 (Unteres Bild). Dieses Molekül kann durchaus dehydrierend die HCLO bilden2, oder indem es niedrige Temperaturen ausgesetzt wird. Das Detail ist, dass es sich zersetzt, um CL zu produzieren2, ENTWEDER2, oder andere thermodynamisch stabilere Chloroxide.
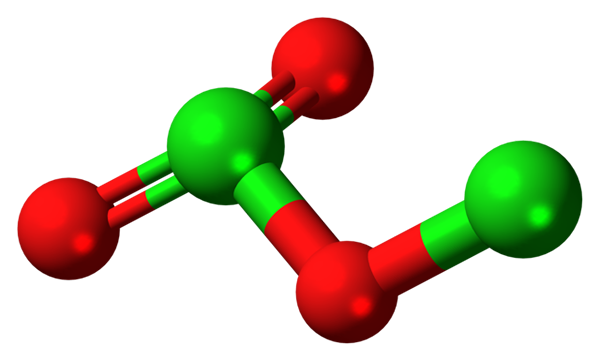
 Dicloro -Trioxidmolekül. Quelle: Jynto [CC0].
Dicloro -Trioxidmolekül. Quelle: Jynto [CC0]. Da die CL-O-Anleihen wenig polar sind, E-Mail CL-E-Mail2ENTWEDER3 Es hat einen kleinen Dipolmoment; Daher löst es sich in Wasser nicht gut auf oder interagiert nicht mit anderen polaren Lösungsmitteln. Seine Instabilität ist so, dass sie keine kommerziellen oder potenziellen Verwendungszwecke bekannt ist (oder als explosiver seine Anwendbarkeit wäre lebensfähig).
Der Hauptgrund für seine Instabilität kann auf die elektronischen Eigenschaften des mutmaßlichen CL zurückzuführen sein3+ (Annahme eines rein ionischen Charakters). Tatsächlich sind seine Oxidation +1 und +5 Zustände am stabilsten, wenn Chlor Verbindungen mit Sauerstoff bildet.
[TOC]
Eigenschaften
Da seine Charakterisierung schlecht und nicht dokumentiert ist, gibt es außer den folgenden Punkten nicht viel zu sagen:
-Es hat eine molekulare Masse von 118.903.
-Es ist ein solides dunkelbraun; Obwohl Sie gasöses Chlor untergraben und gelbliche grüne Dämpfe sagen können.
-Es fehlt sowohl der Siede- als auch der Fusionspunkt, da es bei 0ºC explodiert (und auch bei kälteren Temperaturen).
Kann Ihnen dienen: Dihydroxyacetonphosphat (DHAP): Eigenschaften und Anwendungen-Seine Löslichkeit im Wasser wird rund 3,42 g/100 ml geschätzt, was beweist, dass es sich um ein kovalentes Molekül mit geringer Polarität handelt.
-Reagiert mit Wasser (das kleine, das sich auflöst), um der HCLO zu werden2:
Cl2ENTWEDER3 + H2Oder 2HCLO2
Chloroxidstruktur (III)
Im Bild wurde die molekulare Struktur des CL gezeigt2ENTWEDER3 Mit einem Kugeln und Bars Modell. Obwohl es dem bloßen Auge nicht erscheint, sind die stillschweigenden Auswirkungen ihrer räumlichen Verbindungen und Anordnungen komplizierter als sie erscheinen. Diese Struktur entspricht einem der vielen möglichen Isomere für diese Verbindung.
Die roten Kugeln entsprechen Sauerstoffatomen und den grünen Chloratomen. Das Chlor auf der linken Seite zeigt eine trigonale Pyramidengeometrie mit ein paar freien Elektronen; Es kann also angenommen werden, dass Ihre Hybridisierung SP sein muss3. Ein Sauerstoffatom fungiert als Brücke zwischen den beiden Chloros, Cl-O-CL.
Isomere
Was sind die anderen Isomere? Theoretisch werden neun berechnet, von denen vier am stabilsten sind (einschließlich des Bildes). Die anderen drei hätten Strukturen wie:
-Clclo3. Sehr ähnlich dem erklärten, aber mit einem Cl-Cl-Cl-Link.
-Clooocl (1). In diesem Isomer gibt es eine Brücke von drei Sauerstoff, die die beiden Chloratome trennen2Oder um es visualisieren).
-Clooocl (2). Die gleiche sauerstoffhaltige Brücke ist auch in diesem Isomer vorhanden, mit Ausnahme der beiden Chloratome sind im Weltraum in den Schatten gestellt; Einer voreinander, während sie im vorherigen Isomer weit entfernt sind.
Es kann Ihnen dienen: AlquinosNomenklatur
Sein Name Chloroxid (III) entspricht der gemäß der Aktiennomenklatur zugewiesenen. Hier wird angenommen, dass Chlor einen Oxidationszustand von +3 hat; Aber es bedeutet nicht, dass das Clin3+ kann vorhanden sein. Es ist ein Molekül, kein Ionennetzwerk.
Ein anderer Name, mit dem der CL ebenfalls bekannt ist2ENTWEDER3 Es ist laut systematischer Nomenklatur ein Diclor -Trioxid.
Und endgültig. Dieser Name ist auf die Tatsache zurückzuführen, dass, wie bereits erläutert, der CL2ENTWEDER3 Es tritt auf, wenn der HCLO2 Es kondensiert Wasser, das Wasser verwässert.
Anwendungen
Da es sich um ein Chloroxid handelt, ist der unmittelbarste Gebrauch, der für den CL gedacht werden könnte2ENTWEDER3 Es ist wie ein Oxidationsmittel, das in der Lage ist, organische Verunreinigungen und Mikroben zu neutralisieren. Es ist jedoch sehr instabil, zusätzlich zu Sprengstoff, so dass es für diesen Zweck als nützlich angesehen wird.
Sicher gibt es keine Informationen, selbst wie sich der CL verhalten würde2ENTWEDER3 unter enormen Druck (wenn es im Prozess nicht explodiert). Unter normalen Bedingungen scheint es nur ein relativ stabiler und differenzierbarer Vermittler unter anderen stabileren Chloroxiden zu sein.
Berechnete Untersuchung wurde jedoch untersucht.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Trioxid Dichlorin. Abgerufen von: in.Wikipedia.Org
- Gib ihm l. Perry. (2011). Handbuch an anorganischer Verbindungen. (Zweite Ausgabe). CRC Press Taylor & Francis Group.
- Richard c. Ropp. (2013). Enzyklopädie der alkalischen Erdverbindungen. Elsevier.
- Kim k. H., Han und.K., und lesen und. S. (1999). Basissatzeffekte auf die Stabilität der CL2O3 -Isomere unter Verwendung von B3P86- und B3LYP -Methoden der Dichtefunktionstheorie. Journal of Molekularstruktur Theochem 460 (1-3): 19-25.
- « Eisenhydroxid (ii) Struktur, Eigenschaften, verwendet, verwendet
- Tetrodotoxinstruktur, Eigenschaften, Verwendungen, Effekte »

