
- 3069
- 738
- Timo Rabenstein
Er Phosphoroxid (V) Es ist ein anorganischer Feststoff, der durch Phosphor (P) und Sauerstoff (O) gebildet wird. Seine empirische Formel ist p2ENTWEDER5, während seine korrekte molekulare Formel p ist4ENTWEDER10. Es ist ein sehr hygroskopischer weißer Feststoff, dh es kann sehr leicht Luft von der Luft absorbieren und sofort damit reagieren. Die Reaktion kann gefährlich sein, da sie einen raschen Anstieg der Temperatur verursacht.
.
 Phosphoroxid (V) Pulver, p4ENTWEDER10. Lhchem [CC BY-S (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons.
Phosphoroxid (V) Pulver, p4ENTWEDER10. Lhchem [CC BY-S (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons. . Darüber hinaus ermöglicht es, bestimmte organische Säuren in Ester umzuwandeln.
Es wurde zum Beispiel verwendet, um Benzin zu verfeinern, Phosphorsäure H herzustellen3Po4, Um Verbindungen zu erhalten, die dazu dienen, das Feuer zu verzögern, Glas für Vakuumanwendungen herzustellen, unter anderem.
Phosphoroxid (V) sollte in gut festgelegten Behältern gehalten werden, um den Kontakt mit der Feuchtigkeit aus der Luft zu verhindern. Es ist ätzend und kann Augen, Haut und Schleim schaden lassen.
[TOC]
Struktur
Phosphoroxid (V) wird durch Phosphor (P) und Sauerstoff (O) gebildet, wobei Phosphor eine Valenz von +5 und Sauerstoff -2 aufweist. Das Phosphoroxidmolekül (V) hat vier Phosphor- und zehn Sauerstoffatome und deshalb ist seine korrekte molekulare Formel p p4ENTWEDER10.
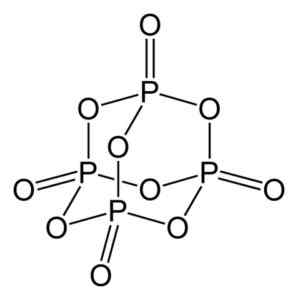 Struktur des Phosphoroxidmoleküls (V), p4ENTWEDER10. Autor: Benjah-BMM27. Quelle: Wikimedia Commons.
Struktur des Phosphoroxidmoleküls (V), p4ENTWEDER10. Autor: Benjah-BMM27. Quelle: Wikimedia Commons. Existiert in drei kristallinen Formen wie amorphem Staub und in einer Glaskörperform (wie Glas). In der hexagonalen kristallinen Form befindet sich jedes der Phosphoratome in den Eckpunkten eines Tetraeders.
Nomenklatur
-
- Phosphorpentoxid
- Diphosphack -Pentoxid
- Phosphorpentoxid
- Phosphoranhydrid
- Tetrafosphor -Zerfall
Eigenschaften
Körperlicher Status
. Die häufigste Form ist die von sechseckigen Kristallen.
Molekulargewicht
283.89 g/mol
Schmelzpunkt
. Dies bedeutet, dass bei dieser Temperatur vom Gas festgelegt wird, ohne durch den flüssigen Zustand zu gehen.
Dichte
3
Löslichkeit
Sehr löslich in Wasser. Schwefelsäure löslich. .
Chemische Eigenschaften
3Po4. Diese Reaktion ist exotherm, was bedeutet, dass Wärme im selben erzeugt wird.
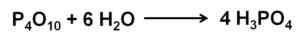 Phosphor (V) Oxidreaktion mit Wasser zur Bildung von Phosphorsäure H3Po4. Autor: Marilú Stea.
Phosphor (V) Oxidreaktion mit Wasser zur Bildung von Phosphorsäure H3Po4. Autor: Marilú Stea. Die Reaktion von p4ENTWEDER10 mit Wasser führt zur Bildung einer Mischung aus Phosphorsäuren, deren Zusammensetzung von der Menge an Wasser und Bedingungen abhängt.
Die Reaktion mit Alkoholen führt in Abhängigkeit von den experimentellen Bedingungen zur Bildung von Phosphorsäure oder Polymersäureester.
P4ENTWEDER10 + 6 ROH → 2 (RO)2Po.OH + 2 RO.2
.
. Es kann gefährlich mit Ameisensäure und anorganischen Basen wie Natriumhydroxid (NaOH), Calciumoxid (CAO) oder Natriumcarbonat NA reagieren2CO3.
4 und CHCL Chloroform3 In Phosphoroxid (v) p4ENTWEDER10 Eine gewalttätige Explosion tritt auf.
Andere Eigenschaften
Es ist nicht brennbar. Bevorzugt die Verbrennung nicht. .
Erhalten
. .
P4 + 5 o2 → p4ENTWEDER10
Präsenz in der Natur
Phosphoroxid (V) kommt in Mineralien wie Ilmenit, Rutilo und Zircón vor.
?Der Ilmenit ist ein Mineral, das Eisen und Titan enthält und manchmal Phosphor (V) Oxid in Konzentrationen aufweist, die zwischen 0,04 und 0,33% variieren. 2ENTWEDER5.
.
Anwendungen
.
Kann Wasser aus Substanzen extrahieren, die als dehydrierende Wirkstoffe angesehen werden. Zum Beispiel können Sie Wasser aus Schwefelsäure H entfernen H2SW4 es so machen3 3 verwandeln es in n2ENTWEDER5.
 Schwefelsäuredehydration aufgrund von Phosphoroxid (V). Autor: Marilú Stea.
Schwefelsäuredehydration aufgrund von Phosphoroxid (V). Autor: Marilú Stea. .
In organischen Chemiereaktionen
Phosphoroxid (V) dient dazu, organische Verbindungsringe und andere Kondensationsreaktionen zu schließen.
.
2Oder der Amidas r (c = o) nh2 Und es macht sie nitriles r-cn. .
 4ENTWEDER10 Es wird häufig in Laboratorien für organische Chemie verwendet. Autor: JDN2001CN0. Quelle: Pixabay.
4ENTWEDER10 Es wird häufig in Laboratorien für organische Chemie verwendet. Autor: JDN2001CN0. Quelle: Pixabay. Seit den 1930er Jahren des 20. Jahrhunderts zeigten bestimmte Studien, dass Phosphor (V) Oxid eine Gasraffinierungswirkung ausübte und seine Oktan erhöhte.
Die raffinierende Wirkung von p4ENTWEDER10 Es ist hauptsächlich auf Kondensationsreaktionen (Vereinigung verschiedener Moleküle) und nicht auf Polymerisation (Bindung gleicher Moleküle) zurückzuführen.
Kann Ihnen dienen: Natriumacetat: Struktur, Eigenschaften, Synthese, verwendetDie p4ENTWEDER10 Beschleunigt direkte alomatische Kohlenwasserstoffe mit Olefin -Kohlenwasserstoffen, Olefin -Umwandlung in Naphthen und partielle Polymerisation. Die Alkylierungsreaktion erhöht die Oktanzahl von Benzin.
Auf diese Weise wird ein hochwertiges raffiniertes Benzin erhalten.
 Einige Ölderivate können durch die Wirkung von p verbessert werden4ENTWEDER10 . Autor: drpeperScott230. Quelle: Pixabay.
Einige Ölderivate können durch die Wirkung von p verbessert werden4ENTWEDER10 . Autor: drpeperScott230. Quelle: Pixabay. In verschiedenen Anwendungen
- 3Po4
-
- Bereiten Sie Phosphatester vor
-
- Laborreagenz
- Hersteller Spezialgläser für Vakuumrohre
- Erhöhen Sie den Asphaltschmelzepunkt
- Dienen als Standardmolekül bei der Bestimmung von Phosphor oder Phosphaten in phosphatischen Gesteinen, Düngemitteln und Portlandzement in Form von p2ENTWEDER5
-
 4ENTWEDER10 während seiner Herstellung. Tvezymer [Public Domain]. Quelle: Wikimedia Commons.
4ENTWEDER10 während seiner Herstellung. Tvezymer [Public Domain]. Quelle: Wikimedia Commons. Risiken
Phosphoroxid (V) muss in versiegelten Behältern und an frischen, trockenen und gut belüfteten Stellen gehalten werden.
Dies dient dazu, zu verhindern, dass es nicht mit Wasser kontaktiert wird, da es heftig damit reagieren kann und sehr Wärme erzeugt, bis zum Verbrennen von Materialien, die brennbar sind.
Phosphoroxid (V) Staub ist irritierend Augen- und Atemweg und korrosiv für die Haut. Es kann Verbrennungen in den Augen erzeugen. Durch Einnahme verursachen tödliche innere Verbrennungen.
Verweise
- ODER.S. Nationalbibliothek für Medizin. (2019). Phosphoranhydrid. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- . (2001). . Chemische Modifikation. . Von Scientedirect erholt.com.
- Malishev, b.W. (1936). . Chemie für Industrie und Engineering 1936, 28, 2, 190-193. Aus Pubs geborgen.ACS.Org.
- Epps, jr. UND.ZU. (1950). . Analytische Chemie 1950, 22, 8, 1062-10633. Aus Pubs geborgen.ACS.Org.
- . et al. (1983). Verwendung von Phosphorpentoxid: Veresterung von organischen Säuren. J. Org. Chem. 1983, 48, 3108-3109. Aus Pubs geborgen.ACS.Org.
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- Kirk-Othmer (1994). Enzyklopädie der chemischen Technologie. Vierte Edition. John Wiley & Söhne.
- Ogliari, f.ZU. et al. (2008). Synthese von Phosphatmonomeren und Bindung an Dentin: Veresterungsmethoden und Verwendung von Phosphorpentoxid. Journal of Dentistry, Band 36, Ausgabe 3, März 2008, Seiten 171-177. Von Scientedirect erholt.com.
- « Aluminiumacetat (Al (CH3CO) 3) Struktur, Eigenschaften, verwendet
- Notation entwickelte was, Beispiele und Übungen »

