Lithiumoxid
- 989
- 184
- Timo Rabenstein
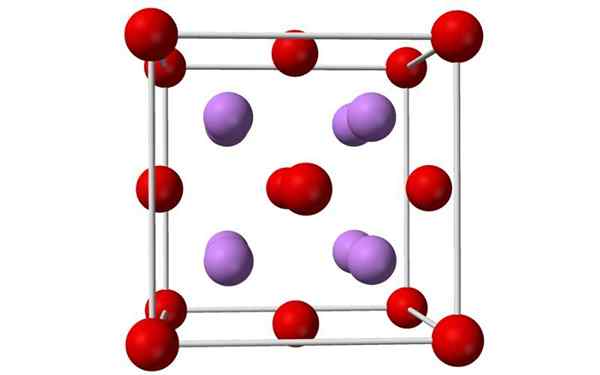
 Kugeln und Balken Modell einer einheitlichen Lithiumoxidzelle. Quelle: Benjah-BMM27, Wikimedia Commons
Kugeln und Balken Modell einer einheitlichen Lithiumoxidzelle. Quelle: Benjah-BMM27, Wikimedia Commons Was ist Lithiumoxid?
Er Lithiumoxid Es ist eine anorganische chemische Verbindung der Formel Li2Oder das wird zusammen mit geringen Mengen Lithiumperoxid gebildet, wenn das Lithiummetall in der Luft verbrannt wird und sich mit Sauerstoff verbindet.
Bis in die 90er Jahre wurde der Metall- und Lithiummarkt von der US -Produktion aus Mineraleinlagen dominiert, aber zu Beginn des 21. Jahrhunderts stammte der größte Teil der Produktion aus anderen Quellen: Australien, Chile und Portugal waren die wichtigsten Lieferanten der Welt. Bolivien hat die Hälfte der Lithiumablagerungen in der Welt, aber es ist kein großartiger Produzent.
Die wichtigste kommerzielle Form ist Lithiumcarbonat, li2CO3, produziert aus Mineralien oder Salmuelas durch verschiedene Prozesse.
Wenn Lithium in der Luft brennt, ist das Hauptprodukt weißes Lithiumoxidoxid, li2ENTWEDER. Darüber hinaus tritt etwas Lithiumperoxid auf, li2ENTWEDER2, Auch weiß.
Es kann auch durch die thermische Zersetzung von Lithiumhydroxid, Lioh oder Lithiumperoxid, Li, erfolgen2ENTWEDER2.
4li (s) + o2(g) → 2LI2Du)
2lioh (s) + Wärme → li2Oder (s) + h₂o (g)
2li2ENTWEDER2(s) + Wärme → 2LI2Oder (s) + oder2(G)
Physikalische und chemische Eigenschaften
- Lithiumoxid ist ein weißer Feststoff, der als Lithia bekannt ist, dem ein Aroma fehlt und salziges Geschmack hat.
- Lithiumoxid sind Kristalle mit Antifloritgeometrie, ähnlich wie Natriumchlorid (Kubikmitte auf Gesichtern).
- Sein Molekulargewicht beträgt 29,88 g/mol, seine Dichte beträgt 2.013 g/ml und die Fusions- und Siedepunkte beträgt 1438 ° C bzw. 2066 ° C.
Es kann Ihnen dienen: epid- Die Verbindung ist sehr löslich in Wasser, Alkohol, Äther, Pyridin und Nitrobenzol.
- Lithiumoxid reagiert leicht mit Wasserdampf zur Bildung von Hydroxid und Kohlendioxid zur Bildung von Carbonat; Daher muss es in einer sauberen und trockenen Atmosphäre gelagert und verwaltet werden.
- Oxidverbindungen leiten keinen Elektrizität. Bestimmte strukturierte Oxide von Perovskita sind jedoch elektronisch leitfähig, die die Anwendung in den kathoden- und Sauerstofferzeugungssystemen finden.
- Es sind Verbindungen, die mindestens ein Sauerstoffanion und ein metallisches Kation enthalten.
Risiken
Lithiumoxid ist eine stabile Verbindung, die mit starken Säuren, Wasser und Kohlendioxid nicht kompatibel ist. Soweit wir wissen.
Die Toxizität von Lithiumverbindungen ist eine Funktion ihrer Löslichkeit im Wasser. Das Lithiumionen hat eine Toxizität im Zentralnervensystem. Die Verbindung ist sehr korrosiv und irritiert, wenn sie mit den Augen und der Haut in Kontakt kommt, wenn sie eingeatmet oder aufgenommen wird.
Bei Augenkontakt müssen Sie überprüfen, ob Kontaktlinsen verwendet werden, und sie sofort entfernen. Sie müssen mindestens 15 Minuten lang mit fließendem Wasser gespült werden, um die Augenlider offen zu halten. Kaltes Wasser kann verwendet werden und keine Augensalbe.
Wenn die Chemikalie mit der Kleidung in Kontakt kommt, behalten Sie sie so schnell wie möglich und schützen Sie ihre eigenen Hände und Körper. Legen Sie das Opfer unter eine Sicherheitsdusche.
Wenn sich die Chemikalie in der exponierten Haut des Opfers wie den Händen ansammelt, wird die mit fließende Wasser und nicht abrasive Seife kontaminierte Haut sanft gewaschen und vorsichtig. Kaltes Wasser kann verwendet werden. Wenn Reizungen bestehen, suchen Sie medizinische Hilfe auf. Waschen Sie kontaminierte Kleidung, bevor Sie sie wieder benutzen.
Kann Ihnen dienen: Rankine Scale: Was ist, Conversions, BeispieleIm Inhalation sollte das Opfer in einem gut belüfteten Bereich stehen dürfen. Wenn die Inhalation ernst ist, muss das Opfer so bald wie möglich in einen sicheren Bereich evakuiert werden.
Lösen Sie enge Kleidung wie Hemdhälse, Gürtel oder Krawatte. Wenn das Opfer schwer zu atmen ist, muss Sauerstoff verabreicht werden. Wenn das Opfer nicht atmet, wird eine Wiederbelebung der Mundmund gemacht.
Immer berücksichtigt, dass es für die Person gefährlich sein kann, die Hilfe bietet, die Hilfe für die Wiederbelebung des Mundes anbieten, wenn das inhalierte Material giftig, infektiös oder korrosiv ist. In allen Fällen sollte sofortige medizinische Versorgung gesucht werden.
Anwendungen
- Lithiumoxid wird als Gründer in Keramik -Emaille verwendet und erzeugt Blau mit Kupfer und Rosen mit Kobalt. Reagiert mit Wasser und Dampf, bildet Lithiumhydroxid und sollte von ihnen isoliert werden.
- Lithiumoxid (li2O) mit seinem hohen Tritio -Potential ist es ein attraktiver Kandidat für das feste Kultivierungsmaterial einer DT -Fusionsenergieanlage aufgrund seiner hohen Dichte an Lithiumatomen (im Vergleich zu anderen Lithium- oder metallischen Lithiumkeramiken) und seiner relativ hohen thermischen Leitfähigkeit.
Li2O Es wird bei der Bestrahlung von Neutronen während des Betriebs von Fusionsdecken hohen Temperaturen ausgesetzt sein. Unter diesen Umständen wird eine große Anzahl von Bestrahlungsfehlern in Li erzeugt2Oder wie Helium -induzierte Schwellung, relativ hohe thermische Expansion, Kornwachstum, Lyh (T) -Fbildung und Niederschlag bei niedrigen Temperaturen und Transport der Lioh (T) -Masse bei hohen Temperaturen.
Außerdem das Li2Oder unterliegt Spannungen, die sich aus thermischen Expansionsunterschieden zwischen Li ergeben2O und strukturelle Materialien. Diese Eigenschaften von li2Oder zu herausfordernden technischen Problemen sowohl im Fertigung als auch im Manta -Design führen.
Kann Ihnen dienen: Strontiumhydrid (SRH2)- Eine mögliche neue Verwendung ist wie ein Ersatz für Kobalt und Lithiumoxid, wie die Kathode in Lithium -Ion.
Verweise
- Amerikanische Elemente. Lithiumoxid. Von amerikanischen amerikanischen erholt.com.
- Lithiumoxid. Erholt von Espimetals Espimetals.com.
- Lithiumoxid (Li2o). Ferp erholt sich.UCSD.Edu Ferp.UCSD.Edu.

