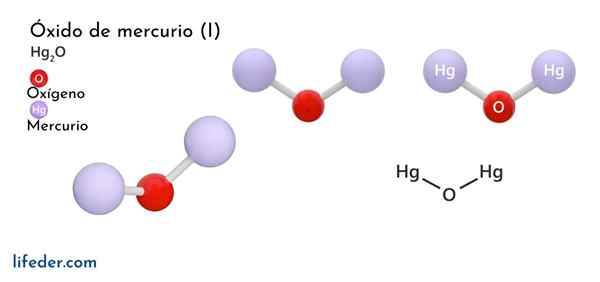
Quecksilberoxid (HG2O)
- 1972
- 407
- Joe Hartwig
Was ist Quecksilberoxid?
Er Quecksilberoxid (I) U -Eisenoxid, dessen chemische Formel als HG dargestellt wird2Oder es ist eine feste Phasenverbindung, die aus chemischer Sicht als toxisch und instabil angesehen wird und sich in Quecksilber in seine elementare Form und Quecksilberoxid verwandelt (II).
Es gibt nur zwei chemische Spezies, die in Kombination mit Sauerstoff in Kombination Quecksilber bilden können, da dieses Metall zwei nur Oxidationszustände hat (HG+ und hg2+): Quecksilberoxid (i) und Quecksilberoxid (II). Quecksilberoxid (II) befindet sich in einem Zustand der festen Aggregation und wird in zwei relativ stabilen kristallinen Formen erhalten.
Diese Verbindung ist auch einfach als Quecksilberoxid bekannt, daher wird hier nur diese Spezies behandelt. Eine sehr häufige Reaktion, die mit dieser Substanz auftritt.
Chemische Struktur
Unter den atmosphärischen Druckbedingungen wird diese Art in zwei kristallinen Formen dargestellt: ein sogenannter Cinabrio und ein weiteres als Montrodit bekannt, was sehr selten ist. Beide Formen werden in tetragonale Drucke über 10 GPa -Druck umgewandelt.
Die Struktur des Cinnabrios basiert auf primitiven hexagonalen Zellen (HP6) mit trigonaler Symmetrie, deren helikale Achse links ausgerichtet ist (p32einundzwanzig); Andererseits ist die Struktur des Montrodits ortorrombisch und basiert auf einem primitiven Gitter, das Flugzeuge senkrecht zu den drei Achsen bildet (PNMA).
Im Gegensatz dazu können zwei Formen von Quecksilberoxid visuell unterschieden werden, da einer rot und der andere Gelb ist. Diese Farbe in der Farbe tritt dank der Abmessungen des Partikels auf, da die beiden Formen die gleiche Struktur haben.
Es kann Ihnen dienen: Circonium: Geschichte, Eigenschaften, Struktur, Risiken, verwendetUm die rote Form des Quecksilberoxids, die metallische Quecksilbererwärmung in Sauerstoff bei einer Temperatur von 350 ° C oder zum Quecksilbernitrat -Pyrolyseprozess (II) (HG (NO) zu erzeugen3)2).
Auf die gleiche Weise, um die gelbe Form dieses Oxids zu erzeugen2+ in wässriger Form mit einer Basis.
Quecksilberoxideigenschaften
- Es hat einen Schmelzpunkt von ungefähr 500 ° C (gleichwertig zu 773 K), über dem, über dem es eine Zerlegung leidet, und eine Molmasse oder ein Molekulargewicht von 216,59 g/mol.
- Es befindet sich in einem Zustand der festen Aggregation in verschiedenen Farben: orange, rot oder gelb gemäß dem Grad der Dispersion.
- Es ist ein Oxid anorganischer Natur, dessen Verhältnis zu Sauerstoff 1: 1 beträgt, was es zu einer binären Spezies macht.
- Es wird in Ammoniak, Aceton, Äther und Alkohol sowie in anderen organischen Natur als unlöslich angesehen.
- Die Löslichkeit im Wasser ist sehr niedrig, bei Standardtemperatur (25 ° C) ungefähr 0,0053 g/100 ml und mit zunehmender Temperatur zunimmt.
- Es wird in den meisten Säuren als löslich angesehen; Die gelbe Form zeigt jedoch eine größere Reaktivität und eine stärkere Auflösungskapazität.
- Wenn das Quecksilberoxid der Zersetzung ausgesetzt ist, während seine rote Form es tut, wenn es Lichtquellen ausgesetzt ist.
- Wenn er sich der Temperatur erhitzt, bei der er zusammenbricht.
- Nur wenn es bis zu 300-350 ° C erhitzt ist.
Kann Ihnen dienen: Chemische SuspensionenVerwendet/Anwendungen
Es wird als Vorläufer bei der Erlangung von elementarem Quecksilber verwendet, da es auf einfache Weise Zerlegungsprozesse erleidet. Im Rahmen des Zersetzens erzeugt es Sauerstoff in seiner Soda -Form.
In ähnlicher Weise wird dieses anorganische Naturoxid als Wertschöpfungsmittel des Standardtyps für anionische Spezies verwendet, da eine Verbindung erzeugt wird, die eine größere Stabilität hat als ihre anfängliche Form.
In diesem Sinne erfährt Quecksilberoxid eine Auflösung, wenn es in konzentrierten Lösungen von Basisarten gefunden wird und Verbindungen produziert.
Diese Verbindungen sind komplex mit M -StrukturX(OH)Und, wobei M ein metallisches Atom darstellt und die Einreise x y y die Anzahl der Zeiten darstellen, die Arten im Molekül gefunden werden. Sie sind in chemischen Untersuchungen von enormer Nützlichkeit.
Darüber hinaus kann Quecksilberoxid (II) in Laboratorien zur Herstellung verschiedener Metallsalze verwendet werden. Zum Beispiel Quecksilberacetat (II), das in organischen Syntheseprozessen verwendet wird.
Diese Verbindung wird auch, wenn sie mit Graphit gemischt ist, als Material für die kathodische Elektrode bei der Herstellung von Quecksilberbatterien und Elektrizität und Zinkoxid -Zellen.
Risiken
- Diese Substanz, die grundlegende Eigenschaften auf sehr schwache Weise manifestiert, ist ein sehr nützliches Reagenz für verschiedene Anwendungen wie die oben genannten.
- Quecksilberoxid hat eine hohe Toxizität, die von der Atemwege absorbiert werden kann, da es in Form von Aerosol irritierende Gase abgibt, sondern auch extrem giftig ist, wenn es aufgenommen wird oder wenn es von der Haut absorbiert wird, wenn es absorbiert wird, wenn es absorbiert wird, wenn es absorbiert wird Damit kommt es direkt in Kontakt.
Kann Ihnen dienen: Chiralität- Diese Verbindung erzeugt Augenreizungen und kann die Nieren schädigen, die anschließend bei Nierenversagensproblemen stammen.
- Wenn diese Chemikalie auf die eine oder andere Weise von aquatischen Arten konsumiert wird, ist sie in diesen Bioacumula und beeinflusst den Organismus von Menschen, die sie regelmäßig konsumieren.
- Die Erwärmung von Quecksilberoxid entsteht Quecksilberdämpfe mit einer hohen Toxizität zusätzlich zum Gassauerstoff, wodurch das Risiko einer Entflammbarkeit erhöht wird. das heißt, Brände zu produzieren und die Verbrennung in diesen zu verbessern.
- Dieses anorganische Oxid hat ein starkes oxidierendes Verhalten und führt daher gewaltsam2S2), Wasserstoffperoxid (H)2ENTWEDER2), Chlor und Magnesium (nur wenn er erhitzt wird).