Goldoxid (III) (Au2O3) Was ist, Struktur, Eigenschaften, verwendet
- 1470
- 129
- René Riediger
Er Goldoxid (III) Es ist eine anorganische Verbindung, deren chemische Formel AU ist2ENTWEDER3. Theoretisch ist seine Natur außerhalb des kovalenten Typs zu erwarten. Das Vorhandensein eines bestimmten ionischen Charakters in seinem Feststoff kann jedoch nicht vollständig ausgeschlossen werden; oder was das gleiche ist, nimmt das Fehlen des Aucation an3+ neben Anion oder2-.
Es mag widersprüchlich erscheinen, dass Gold, ein edler Metall ist, oxidieren kann. Unter normalen Bedingungen können Goldstücke nicht durch Kontakt mit dem Sauerstoff der Atmosphäre oxidieren. Wenn sie jedoch in Gegenwart von Ozon mit ultravioletten Strahlung bestrahlt werden, oder3, Das Panorama ist ein anderer.
Wenn die goldenen Sterne diese Bedingungen unterziehen, würden sie zu einer rötlich -braunen Farbe, die für die Au charakteristisch ist2ENTWEDER3.
Andere Methoden zur Erlangung dieses Oxids würden die chemische Behandlung dieser Sterne implizieren; Zum Beispiel den Goldteig in sein jees Chlorid, Aucl, verwandeln3.
Dann zum Aucl3, Und der Rest der möglichen Goldsalze, ein starkes Grundmedium, wird zugegeben; Und damit wird hydratisiert oder Hydroxidoxid erhalten, au (OH)3. Schließlich ist die letztere Verbindung thermisch dehydriert, um die Au zu erhalten2ENTWEDER3.
Goldoxidstruktur (III)
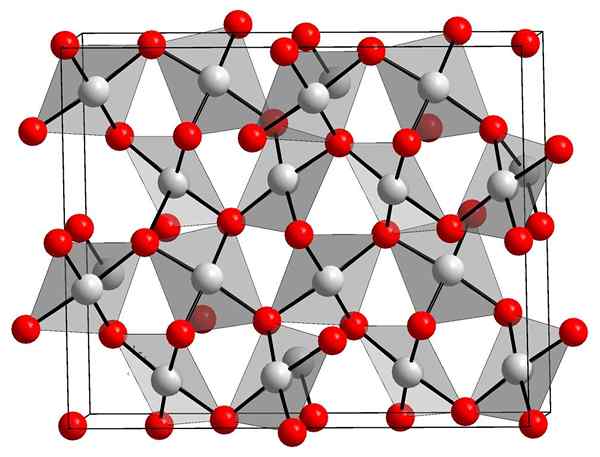
 Kristallstruktur Goldoxid. Orci, Wikimedia Commons.
Kristallstruktur Goldoxid. Orci, Wikimedia Commons. Das obere Bild zeigt die kristalline Struktur von Goldoxid (III). Die Disposition von Gold- und Sauerstoffatomen im Feststoff wird entweder unter Berücksichtigung neutraler Atome (kovalenter Feststoff) oder Ionen (ionischer Feststoff) gezeigt. Außerhaltig, die Au-O-Links in jedem Fall einfach beseitigen oder platzieren.
Nach dem Bild wird angenommen, dass das kovalente Charakter überwiegt (was logisch wäre). Aus diesem Grund werden die mit Kugeln bzw. Balken dargestellten Atome und Verbindungen dargestellt. Weiße Kugeln entsprechen Goldatomen (AUIII-O) und die rötlichen bis Sauerstoffatome.
Kann Ihnen dienen: HydroxyapatitWenn er sorgfältig beobachtet wird, ist zu erkennen, dass es Auo -Einheiten gibt4, die durch Sauerstoffatome binden. Eine andere Möglichkeit, sich zu visualisieren3+ ist von vier oder umgeben2-; Natürlich aus einer ionischen Perspektive.
Diese Struktur ist kristallin, da Atome geordnet werden, indem dem gleichen langen Muster gehorcht. Somit entspricht seine einheitliche Zelle dem rhomboedrischen kristallinen System (das gleiche wie das obere Bild). Daher alle AU2ENTWEDER3 Es könnte gebaut werden, wenn all diese Kugeln der Einheitszelle im Weltraum verteilt würden.
Elektronische Aspekte
Gold ist ein Übergangsmetall, und es wird erwartet, dass seine 5D -Orbitale direkt mit den 2p -Orbitalen des Sauerstoffatoms interagieren. Diese Überlappung seiner Orbitale muss theoretisch Fahrbänder erzeugen, was die AU machen würde2ENTWEDER3 In einem Halbleiter fest.
Daher die wahre Struktur der AU2ENTWEDER3 ist noch komplexer, dies im Sinn zu haben.
Hydrate
Goldoxid kann Wassermoleküle in seinen rhomboédicanischen Kristallen erhalten, was zu Hydraten führt. Wenn solche Hydrate gebildet werden, wird die Struktur amorph, dh ungeordnet.
Die chemische Formel für solche Hydrate kann eine der folgenden sein, was tatsächlich nicht zutiefst geklärt ist: AU2ENTWEDER3∙ zh2O (z = 1, 2, 3 usw.), Au (oh)3, oder auXENTWEDERUnd(OH)z.
Die Au (OH) -Formel3 repräsentiert eine Vereinfachung der wahren Zusammensetzung dieser Hydrate. Dies liegt daran2ENTWEDER3; Und deshalb verliert es die Bedeutung, es isoliert als "einfache" Übergangsmetallhydroxid zu behandeln.
Kann Ihnen dienen: Flüssigkeits-DampfbalanceAndererseits von einer festen mit AU -FormelXENTWEDERUnd(OH)z Eine amorphe Struktur konnte erwartet werden; Da hängt dies von den Koeffizienten ab X, Und Und z, deren Variationen würden zu allen Arten von Struktur führen, die kaum ein kristallines Muster aufweisen könnten.
Eigenschaften
Aussehen
Es ist ein rötlich -brauner Feststoff.
Molekulare Masse
441,93 g/mol.
Dichte
11,34 g/ml.
Schmelzpunkt
Es schmilzt und zersetzt sich bei 160 ° C. Es fehlt ein Siedepunkt, so dass dieses Oxid niemals kocht.
Stabilität
Au2ENTWEDER3 Es ist thermodynamisch instabil, weil Gold, wie am Anfang erwähnt, Gold unter normalen Temperaturbedingungen nicht oxidieren. So dass es leicht reduziert wird, um das edle Gold zu werden.
Je höher die Temperatur, desto schneller wird diese Reaktion, die als thermische Zersetzung bekannt ist. So die Au2ENTWEDER3 Bei 160ºC bricht es zusammen, um metallische Gold- und Molekülsauerstoff zu produzieren:
2 AU2ENTWEDER3 => 4 au + 3 o2
Eine sehr ähnliche Reaktion kann mit anderen Verbindungen auftreten, die diese Reduktion bevorzugen. Warum Reduktion? Weil Gold die Elektronen gewinnt, die Sauerstoff entfernt; Was ist das Gleiche, um Verbindungen zum Sauerstoff zu verlieren.
Löslichkeit
Es ist ein unlöslicher Feststoff im Wasser. Es ist jedoch aufgrund der Bildung von Goldchloriden und Nitraten löslich in Salzsäure und Salpetersäure löslich.
Nomenklatur
Das Goldoxid (III) ist der Name, der der Aktiennomenklatur unterliegt. Andere Möglichkeiten, es zu erwähnen, sind:
-Traditionelle Nomenklatur: Aurikoxid, weil Valencia 3+ das größte für Gold ist.
-Systematische Nomenklatur: Dioro -Trioxid.
Anwendungen
Glasfärbung
Eine der bedeutendsten Verwendungszwecke besteht darin, bestimmte Materialien wie Gläser rötliche Farbe zu verleihen und bestimmte Eigenschaften zu verleihen, die Goldatomen inhärent sind.
Kann Ihnen dienen: Wasserstoffbromid (HBR)Synthese von Auraten und fulminantem Gold
Wenn die AU hinzugefügt wird2ENTWEDER3 Zu einem Medium, in dem es löslich ist, und in Gegenwart von Metallen kann es nach der Zugabe einer starken Basis die Saures ausfallen; die von Auo -Anionen gebildet werden4- In Gesellschaft von Metallkationen.
Auch die AU2ENTWEDER3 reagiert mit Ammoniak, um die fulminante Goldverbindung zu bilden, Au2ENTWEDER3(NH3)4. Sein Name leitet sich aus der Tatsache ab, dass er sehr explosiv ist.
Selbst -sembulierte Monocapas -Manipulation
Auf Gold und seinem Oxid werden bestimmte Verbindungen nicht auf die gleiche Weise adsorbiert, wie z. B. Disulfur Dialil, RSSR. Wenn diese Adsorption auftritt.
RSSR kann nicht über Au adsorbiert werden2ENTWEDER3, Aber über metallisches Gold. Daher, wenn die Oberfläche des Goldes und ihr Oxidationsgrad modifiziert sind, sowie die Größe der Partikel oder Schichten von AU2ENTWEDER3, Eine heterogenere Oberfläche kann entworfen werden.
Diese Oberfläche au2ENTWEDER3-AUSR interagiert mit Metalloxiden bestimmter elektronischer Geräte und entwickelt so zukünftige intelligentere Oberflächen.
Verweise
- Goldoxide. Erholt von: 911Metallurgist.com
- Shi, r. Asahi und c. Stampfl. (2007). Eigenschaften der Goldoxide au2ENTWEDER3 und au2O: Erstprinzipienforschung. Die amerikanische physische Gesellschaft.
- « Chigualcan Was ist, Eigenschaften, Lebensraum, Verwendungen, Eigenschaften
- Hemidesmosomen Was ist, Beschreibung, Struktur, Funktionen »

