Kaliumoxid (K2O)
- 3275
- 149
- Medine Kedzierski
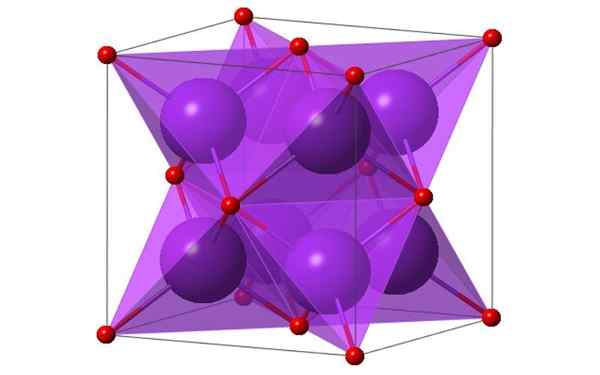
 Kubikdesign von 4 Molekülen Kaliumoxid. Quelle: Ktlabe, Wikimedia Commons
Kubikdesign von 4 Molekülen Kaliumoxid. Quelle: Ktlabe, Wikimedia Commons Was ist Kaliumoxid?
Er Kaliumoxid, Auch Dipotasiumoxid genannt, ist es ein ionischer Sauerstoff und Kaliumsalz mit Formel K2ENTWEDER. Es ist das einfachste Kaliumoxid, hochreaktiv und selten gefunden. Einige Handelsmaterialien wie Düngemittel und Zement2ENTWEDER.
Kaliumoxid wird aus Kaliumhydroxid (ätzender Kali-
2k + 2koh ⇌ 2k2Oder + h2 (450 ° C).
Es wird auch durch Reduzieren von Kaliumperoxid gemäß der Reaktion erhalten:
2k2ENTWEDER2 → k2Oder + o2 (530 ° C).
Eine andere Methode zum Erhalten von Kaliumoxid ist das Erhitzen von Kaliumcarbonat bei hoher Temperatur, wie durch die folgende Reaktion angezeigt:
K2CO3 ⇌ k2O + co₂ (t> 1200 ° C).
Die Hauptmethode zum Erhalten von Kaliumoxid besteht jedoch durch Erwärmen von Kaliumnitrat, die den molekularen Stickstoff erhalten, wie durch die folgende Reaktion angezeigt:
2kno3 + 10k → 6k2Oder + n2
Physikalische und chemische Eigenschaften
- Sie sind tetraedrische Kristalle, gelblich, ohne charakteristisches Aroma.
- Es hat ein Molekulargewicht von 94,2 g/mol und eine Dichte von 2,13 g/ml bei 24 ° C.
- Es hat einen Schmelzpunkt von 740 ° C, obwohl es bei 300 ° C zu zersetzen beginnt.
- Es ist in Ethanol und Äther resistent und löslich. K2Oder in der Antifluoritstruktur kristallisieren. Aus diesem Grund werden die Positionen der Anionen und Kationen in Bezug auf ihre Positionen in der CAF investiert2, mit koordinierten Kaliumionen bis 4 Ionen von Oxid- und Oxidionen koordiniert bei 8 Kalium.
- Es ist ein Basisoxid und reagiert heftig mit Wasser, um ätzendes Kaliumhydroxid zu erzeugen. Es ist delikoszierend und absorbiert Wasser aus der Atmosphäre, wobei diese kräftige Reaktion beginnt.
Es kann Ihnen dienen: Calciumnitrat (CA (NO3) 2)- Es oxidiert reversibel zu Kaliumperoxid bei 350 ° C, reagiert heftig mit Säuren wie Salzsäure, um Kaliumsalze gemäß der Reaktion zu bilden:
K2O + 2HCl → 2KCL + H₂O.
- Reagiert mit Stickstoffdioxid bei Temperaturen zwischen 150 und 200 ° C, um Nitrat und Kaliumnitrit zu bilden:
K2O + 2no2 = Kno2 + Kno3
- Reagieren Sie bei niedrigen Temperaturen mit Ammoniak, um sich nach der Reaktion inmidas und in Kaliumhydroxid zu bilden:
K2O + nh3 (L) → KNH2↓ + KOH (-50 ° C).
Risiken
Kaliumoxid ist eine instabile Substanz. Leicht oxidiert andere Kalium-, Peroxid- oder Kaliumsäure -Oxide (kho). Die Verbindung ist kein Brennstoff, aber sie reagiert kräftig und exotherm mit Wasser, um Kaliumhydroxid (KOH) zu bilden.
Kaliumoxidlösung in Wasser ist eine starke Basis, reagiert heftig mit Säure und korrosiv. Reagiert heftig mit Wasser, das Kaliumhydroxid erzeugt. Greift viele Metalle in Gegenwart von Wasser an.
Die Substanz ist ätzend für Augen, Haut und Atemwege sowie durch Einnahme. Die Inhalation von Aerosol kann Lungenödeme verursachen, deren Symptome sich häufig nach einigen Stunden manifestieren und durch körperliche Anstrengung verschärft werden.
Bei Augenkontakt müssen Sie überprüfen, ob Kontaktlinsen verwendet werden, und sie sofort entfernen. Die Augen sollten mindestens 15 Minuten lang mit fließendem Wasser mit offenen Augenlider gewaschen werden. Kaltes Wasser kann verwendet werden und keine Augensalbe.
Wenn die Chemikalie mit der Kleidung in Kontakt kommt, behalten Sie sie so schnell wie möglich und schützen Sie ihre eigenen Hände und Körper. Legen Sie das Opfer unter eine Sicherheitsdusche.
Wenn sich die Chemikalie in der exponierten Haut, wie z. B. den Händen. Kaltes Wasser kann verwendet werden. Wenn Reizungen bestehen, suchen Sie medizinische Hilfe auf. Waschen Sie kontaminierte Kleidung, bevor Sie sie wieder benutzen.
Es kann Ihnen dienen: Rubidio: Geschichte, Eigenschaften, Struktur, Erhalten, VerwendungenWenn der Hautkontakt schwerwiegend ist, sollte er mit einer Desinfektionsseife gewaschen werden und die mit einer antibakterielle Creme kontaminierte Haut bedecken.
Im Inhalation sollte das Opfer in einem gut belüfteten Bereich stehen dürfen. Wenn die Inhalation ernst ist, muss das Opfer so bald wie möglich in einen sicheren Bereich evakuiert werden.
Lösen Sie enge Kleidung wie Hemdhälse, Gürtel oder Krawatte. Wenn das Opfer schwer zu atmen ist, muss Sauerstoff verabreicht werden. Wenn das Opfer nicht atmet, wird eine Wiederbelebung der Mundmund gemacht.
Immer berücksichtigt, dass es für die Person gefährlich sein kann, die Hilfe bietet, die Hilfe für die Wiederbelebung des Mundes anbieten, wenn das inhalierte Material giftig, infektiös oder korrosiv ist.
Im Falle einer Aufnahme verursacht es kein Erbrechen. Lösen Sie die enge Kleidung. In allen Fällen sollte sofortige medizinische Versorgung gesucht werden.
Anwendungen
- Die chemische Formel k2Oder (oder einfach K) wird in mehreren industriellen Kontexten verwendet: N-P-K-Zahlen für Düngemittel, Zementformeln und Glasformeln.
Es wird oft nicht direkt in diesen Produkten verwendet, aber die Menge an Kalium wird in Bezug auf käquivalent gemeldet2Oder für jede Art von Kaliumverbindungen wie Kaliumcarbonat.
- Kaliumoxid beträgt ungefähr 83% Kalium, während Kaliumchlorid nur 52% beträgt. Kaliumchlorid liefert weniger Kalium als eine gleiche Menge Kaliumoxid.
Wenn ein Dünger zu 30% Kaliumchlorid von Gewicht beträgt, wäre sein Standard -Kaliumindex, basierend auf Kaliumoxid, nur 18,8%. Es wird und/oder zwischen 10 und 100 Tonnen pro Jahr dieser Substanz im europäischen Wirtschaftsraum hergestellt.
Kann Ihnen dienen: Chemie im Alltag: +30 Beispiele- Diese Substanz wird in Laborchemikalien, Düngemitteln, Polymeren und phytosanischen Produkten verwendet. Das K2O Es hat eine industrielle Verwendung, die zur Herstellung einer anderen Substanz (Verwendung von Zwischenprodukten) führt,.
- Kaliumoxid wird in den Bereichen Mischung und/oder Landwirtschaft, Forstwirtschaft und Fischereiformulierung verwendet. Es wird für die Herstellung von Chemikalien, Kunststoffprodukten und Mineralprodukten verwendet (zum Beispiel Gips, Zement).
- Es wird im Freien in langfristigen Materialien mit niedriger Geschwindigkeitsfreisetzung verwendet, z. B. Metall-, Holz- und Kunststoff -Baumaterialien.
- Innen-, langfristige Materialien werden mit niedriger Release -Geschwindigkeit wie Möbeln, Spielzeug, Baumaterial, Vorhängen, Schuhen, Lederprodukten, Papier- und Kartonprodukten, elektronische Geräte verwendet.
- Diese Substanz kann in Produkten mit Steinmaterial, Gips, Zement, Glas oder Keramik vorhanden sein (z.
- Kaliumoxid ist eine thermisch stabile, hoch unlösliche Quelle, die für Glas-, optische und Keramikanwendungen geeignet ist. Oxidverbindungen leiten keinen Elektrizität.
- Es wird auch in leichten strukturellen Komponenten in Luft- und Raumfahrt- und elektrochemischen Anwendungen wie Kraftstoffbatterien verwendet, bei denen die Ionenleitfähigkeit aufweist.
Verweise
- Amerikanische Elemente (s).F.). Kaliumoxid. Von Amerikanern erholt.com.
- Dipsiumoxid. Von echa geborgen.Europa.EU.

