Siliziumoxidstruktur (SiO2), Eigenschaften, Verwendungen, erhalten

- 3239
- 309
- Tizian Liebich
Er Siliziumoxid Es ist ein anorganischer Feststoff, der durch die Vereinigung eines Siliziumatoms und zwei Sauerstoff gebildet wird. Seine chemische Formel ist Siio2. Diese natürliche Verbindung wird auch als Silizium oder Siliziumdioxid bezeichnet.
Der Sio2 Es ist das am häufigsten vorkommende Mineral in der Erdkruste, da der Sand aus Kieselsäure besteht. Gemäß seiner Struktur kann Siliciumdioxid kristallin oder amorph sein. Es ist in Wasser unlöslich, löst sich aber in Alkalien und in Fluorhorsäure HF auf.
 Der Sand ist eine Quelle für Siliziumdioxid sio2. ರವಿಮುಂ [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons.
Der Sand ist eine Quelle für Siliziumdioxid sio2. ರವಿಮುಂ [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons. Der Sio2 Es ist auch in der Struktur bestimmter Pflanzen, Bakterien und Pilze vorhanden. Auch in Skelette von Meeresorganismen. Zusätzlich zum Sand gibt es auch andere Arten von Steinen, die Kieselsäure sind.
Kieselsäure hat eine sehr weit verbreitete Verwendung, um eine Vielzahl von Funktionen zu erfüllen. Der am weitesten verbreitete Gebrauch ist das Filtermaterial von Flüssigkeiten wie Ölen und Ölprodukten, Getränken wie Bier und Wein sowie Fruchtsäfte.
Aber es hat viele andere Anwendungen. Eine der nützlichsten und wichtigsten ist die Herstellung von bioaktivem Glas, das es ermöglicht, „Gerüste“ zu erzeugen, bei dem Knochenzellen wachsen, um fehlende Knochenteile aufgrund von Unfall oder Krankheit zu produzieren.
[TOC]
Struktur
Silicio Sio Dioxid2 Es ist ein Drei -Atom -Molekül, bei dem das Siliziumatom mit zwei Sauerstoffatomen mit kovalenten Bindungen verbunden ist.
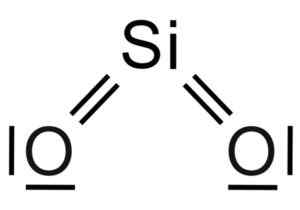 Chemische Struktur des SiO -Moleküls2. Grasso Luigi [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons.
Chemische Struktur des SiO -Moleküls2. Grasso Luigi [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons. Die Struktureinheit von fester Kieselsäure als solches ist ein Tetraeder, in dem ein Siliziumatom von 4 Sauerstoffatomen umgeben ist.
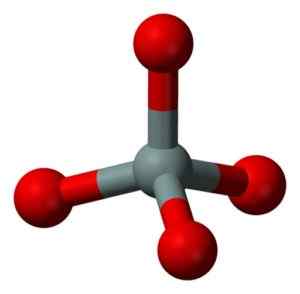 Struktureinheit von fester Kieselsäure: Grau = Silizium, rot = Sauerstoff. Benjah-BMM27 [Public Domain]. Quelle: Wikimedia Commons.
Struktureinheit von fester Kieselsäure: Grau = Silizium, rot = Sauerstoff. Benjah-BMM27 [Public Domain]. Quelle: Wikimedia Commons. Die Tetraeder binden aneinander, die die Sauerstoffatome ihrer zusammenhängenden Eckpunkte teilen.
Deshalb teilt ein Siliziumatom in der Hälfte jedes der 4 Sauerstoffatome und dies erklärt das Verhältnis in der Verbindung von 1 Siliziumatom bei 2 Sauerstoffatomen (SiO2).
 Tetraeder teilen Sauerstoff im SiO2. Benjah-BMM27 [Public Domain]. Quelle: Wikimedia Commons.
Tetraeder teilen Sauerstoff im SiO2. Benjah-BMM27 [Public Domain]. Quelle: Wikimedia Commons. SiO -Verbindungen2 Sie sind in zwei Gruppen unterteilt: kristalline Kieselsäure und amorphe Kieselsäure.
Kristalline Silica -Verbindungen haben Strukturen mit sich wiederholenden Muster von Silizium und Sauerstoff.
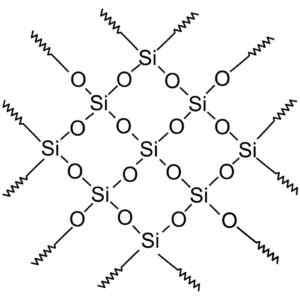 Kristalline Kieselsäure hat sich wiederholende Einheiten. Wereję rastrową wykonał użytkownik Polskiego projektu wikipedii: Polyimerek, ZwekoToryzował: Krzysztof Zajączkowski [GFDL (http: // wwwwwwww.Gnu.Org/copyleft/fdl.html)]. Quelle: Wikimedia Commons.
Kristalline Kieselsäure hat sich wiederholende Einheiten. Wereję rastrową wykonał użytkownik Polskiego projektu wikipedii: Polyimerek, ZwekoToryzował: Krzysztof Zajączkowski [GFDL (http: // wwwwwwww.Gnu.Org/copyleft/fdl.html)]. Quelle: Wikimedia Commons. Alle Silica -Kristall können als ein riesiges Molekül betrachtet werden, in dem das kristalline Netzwerk sehr stark ist. Tetraeder kann auf verschiedene Weise miteinander verbunden werden, was zu verschiedenen kristallinen Formen führt.
Kann Ihnen dienen: Bravais -Netzwerke: Konzept, Merkmale, Beispiele, ÜbungenIn amorphen Kieselsäure sind die Strukturen zufällig miteinander verbunden, ohne ein regelmäßiges Muster zwischen den Molekülen zu folgen, und diese sind in einer anderen räumlichen Beziehung miteinander verbunden.
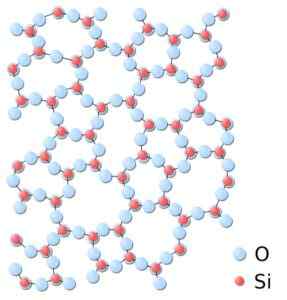 In amorphen Kieselsäure sind die Gewerkschaften nicht wiederholt oder gleichmäßig. Kieselsäure.SVG: *Kieselsäure.JPG: In: Benutzer: JDrewittderivevative Arbeit: Matt [Public Domain]. Quelle: Wikimedia Commons.
In amorphen Kieselsäure sind die Gewerkschaften nicht wiederholt oder gleichmäßig. Kieselsäure.SVG: *Kieselsäure.JPG: In: Benutzer: JDrewittderivevative Arbeit: Matt [Public Domain]. Quelle: Wikimedia Commons. Nomenklatur
-Siliziumoxid
-Siliciumdioxid
-Kieselsäure
-Quarz
-Tridimita
-Cristobalita
-Dioxosilano
Eigenschaften
Körperlicher Status
Farblos zu grau.
 SIO -Probe2 rein. Lhchem [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons.
SIO -Probe2 rein. Lhchem [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons. Molekulargewicht
60.084 g/mol
Schmelzpunkt
1713 ºC
Siedepunkt
2230 ºC
Dichte
2,17-2,32 g/cm3
Löslichkeit
Nicht in Wasser löslich. Amorphes Kiesel. Löslich in Fluorhorhorsäure HF.
Amorphes Kieselsäure ist weniger hydrophil, dh weniger mit Wasser verwandt als mit Kristalline.
Chemische Eigenschaften
Der Sio2 o Siliciumdioxid ist im Wesentlichen für die meisten Substanzen inert, es ist sehr wenig reaktiv.
Widersteht dem Angriff des Chlor CL2, Bromo BR2, Wasserstoff h2 und von den meisten Säuren bei Raumtemperatur oder etwas höher. Wird durch Fluor f angegriffen2, HF Fluorhorsäure und Alkalien wie Natriumcarbonat2CO3.
Der Sio2 Es kann mit Metallelementen und Oxiden kombiniert werden, um Silikate zu bilden. Wenn Siliciumdioxid mit alkalischen Metallcarbonaten bei ungefähr 1300 ° C schmilzt, werden alkalische Silikate erhalten und co2.
Es ist kein Kraftstoff. Es hat eine niedrige thermische Leitfähigkeit.
Präsenz in der Natur
Die Hauptkieselquelle in der Natur ist Sand.
Der Sio2 o Siliciumdioxid ist in Form von drei kristallinen Sorten: Quarz (am stabilsten), Tridimita und Cristobalita. Amorphant für Kieselsäure sind die Agata, der Jaspe und die Ónice. Das Opal ist ein amorphes hydratisiertes Siliciumdioxid.
Es gibt auch das sogenannte biogene Siliciumdioxid, dh das, das von lebenden Organismen erzeugt wird. Quellen dieser Art von Kieselsäure sind Bakterien, Pilze, Diatomeen, Meeresschwämme und Pflanzen.
Die hellen und harten Teile des Bambus und des Strohhalms enthalten Kieselsäure, und die Skelette einiger Meeresorganismen haben ebenfalls einen großen Anteil an Kieselsäure; Am wichtigsten sind jedoch Diatomatoren.
Diatomenland sind geologische Produkte von verfallenen einzelligen Organismen (Algen).
Kann Ihnen dienen: kosmischer StaubAndere Arten von natürlichen Kieselsäure
In der Natur gibt es auch die folgenden Sorten:
- Glassilicaner, die Vulkanglas sind
- Die Milleritas, die durch die Verschmelzung von silicienöser Material unter dem Einfluss von Meteoriten natürliches Glas erzeugt werden
- Das geschmolzene Siliciumdioxid, das Kieselsäure in die Flüssigkeit und gekühlte Phase erhitzt hat, ohne einen Kristallic zuzulassen
Erhalten
Kieselsäure aus Arenen wird direkt aus den Steinbrüchen erhalten.
 Arena Steinbruch in Kalifornien. Ruff Tux Cream Puff [CC0]. Quelle: Wikimedia Commons.
Arena Steinbruch in Kalifornien. Ruff Tux Cream Puff [CC0]. Quelle: Wikimedia Commons. Die Kieselalge oder Kieselalgen werden auch auf diese Weise erhalten, wobei ähnliche Bagger und Geräte verwendet werden.
Amorphes Siliciumdioxid wird basierend auf wässrigen alkalischen Metall -Silikat -Lösungen (wie Natriumna) durch Neutralisation mit Säure wie Schwefelsäure H hergestellt2SW4, HCL -Salzsäure oder Kohlendioxid2.
Wenn der endgültige pH -Wert der Lösung neutral oder alkalisch ist, wird ausgefällte Kieselsäure erhalten. Wenn der pH -Wert saure ist, wird Gel Silica erhalten.
Pyrogenes Siliciumdioxid wird durch Verbrennung einer flüchtigen Siliziumverbindung hergestellt, normalerweise Siliziumsicl -Tetrachlorid4. Das ausgefällte Kieselsäure wird aus einer wässrigen Lösung von Silikaten erhalten, zu denen Säure zugegeben wird.
Kolloidales Siliciumdioxid ist eine stabile Dispersion amorpher kolloidaler Partikel in einer wässrigen Lösung.
Anwendungen
In mehreren Anwendungen
Kieselsäure oder Siio2 Es hat eine Vielzahl von Funktionen, zum Beispiel dient es als abrasiv, absorbierend, antiapelmazante, ausgestopfte, optimierende und die Suspendierung anderer Substanzen, unter anderem Beschäftigungsmodi.
Es wird zum Beispiel verwendet:
-In Glas-, Keramik-, feuerfest, abrasiven und löslichen Glasherstellung
-Verfärbung und Reinigung von Ölen und Ölprodukten
-In Formen für die Gießerei
-Als Antiapelmazante von Pulvern aller Art
-Als antispumant
-Flüssigkeiten wie trockenes Waschen, Lösungsmittel, das Wasser der Pools sowie des kommunalen und industriellen Abwassers zu filtern
-Bei der Herstellung von Wärmeisolatoren, feuerfesten Ziegeln und Verpackungsmaterialien, die gegen Feuer und Säuren resistent sind
-Als Ausfüllen der Herstellung von Papieren und Karten, um sie widerstandsfähiger zu machen
-Wie mit Gemälden gefüllt, um seinen Fluss und seine Farbe zu verbessern
-In Materialien für Metallpolieren und Holz, wie sie ihnen eine Abrasivität verleihen
-In chemischen Analyselabors in Chromatographie und als saugfähig
-Als Antiapelmazante von Insektizid und agrochemischen Formeln, um Pestizid und als Träger der aktiven Verbindung zu mahlen
-Als Katalysatorunterstützung
-Als Füllung zur Verstärkung synthetischer Gummi und Gummi
Kann Ihnen dienen: Längswellen: Eigenschaften, Unterschiede, Beispiele-Als Träger von Flüssigkeiten in tierischen Nahrung
-In gedruckten Tinten
-Als Trockenmittel und Adsorbens in Form von Kieselgel
-Als additiv im Zement
-Als Haustiersand
-In Mikroelektronik -Isolatoren
-In Thermoptic Switches
 Kieselgel. Kenpei [CC BY-SA 3.0 (http: // creativecommons.Org/lizenzen/by-sa/3.0/]]. Quelle: Wikimedia Commons.
Kieselgel. Kenpei [CC BY-SA 3.0 (http: // creativecommons.Org/lizenzen/by-sa/3.0/]]. Quelle: Wikimedia Commons. In der Lebensmittelindustrie
Eine amorphe Siliciumdioxid wird in eine Vielzahl von Lebensmitteln als multifunktionaler direkter Bestandteil in verschiedenen Arten von Lebensmitteln eingebaut. Sie sollten 2% der fertigen Lebensmittel nicht überschreiten.
Zum Beispiel dient es als Antiapelmazante (um zu verhindern, dass bestimmte Lebensmittel festhalten), als Stabilisator bei der Herstellung von Bier als Antiprezitator, um Wein, Bier und Fruchtsäfte oder Gemüse zu filtern.
 Team für die Weinfilterung mit Kieselalgen (SiO2). Fabio Ingroso [CC von 2.0 (https: // creativecommons.Org/lizenzen/by/2.0)]]. Quelle: Wikimedia Commons.
Team für die Weinfilterung mit Kieselalgen (SiO2). Fabio Ingroso [CC von 2.0 (https: // creativecommons.Org/lizenzen/by/2.0)]]. Quelle: Wikimedia Commons. Es wirkt als flüssiger saugfähig in einigen Lebensmitteln und Bestandteilen von Mikrokapseln zum Aromaölen.
Außerdem der SiO2 Amorph wird durch einen speziellen Prozess auf der Oberfläche der Kunststoffe von Artikeln zum Packen von Lebensmitteln und als Barriere aufgetragen.
In der Pharmaindustrie
Es wird als Antiapelmazante -Wirkstoff, Verdickung, Gelier und als Hilfsmittel hinzugefügt, dh als Assistent, um mehrere Medikamente und Vitamine zu formen.
In der Kosmetikindustrie und der persönlichen Pflege
Es wird in einer Vielzahl von Produkten verwendet: in Gesichtspulvern, Lidschatten, Augenhyeliner, Lippenstiften, Färben, Make -up -Schutzhütten, Talcos, Füßepulver, Haarfarbstoffen und Bleichmittel und Bleichmittel.
Auch in Ölen und Badesalzen, Schaumstoffbädern, Händen und Körpercreme.
Auch in Nachthydrat -Cremes, Helligkeit und Nagelfarbe.
In therapeutischen Anwendungen
Der Sio2 Es ist in bioaktivem oder Biovidrios -Glas vorhanden.
Diese Art von Material dient dazu, Knochensubstitute wie die des Gesichts zu machen, wie z. B. "Gerüst", in dem Knochenzellen wachsen werden. Sie haben eine gute Biokompatibilität mit Knochen und Weichteilen gezeigt.
Diese Biovidrios ermöglichen es, Knochen vom Gesicht bis zu Menschen zurückzugewinnen, die sie durch Unfall oder Krankheit verloren haben.
Risiken
Sehr dünne Silica -Partikel können in der Luft aufgehängt werden und bilden nicht explosive Pulver. Aber dieser Staub kann Haut und Augen reizen. Seine Inhalation verursacht Reizungen der Atemwege.
Darüber hinaus erzeugt die Inhalation von Silica -Staub eine langfristige Schädigung der Lunge, die als Silikose bezeichnet wird.
Verweise
- ODER.S. Nationalbibliothek für Medizin. (2019). Siliciumdioxid. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- Da Silva, m.R. et al. (2017). Grüne Extraktionstechniken. SORBNTs auf Kieselsäure basieren. Im Verständnis der analytischen Chemie. Von Scientedirect erholt.com.
- Ylänen, h. (Editor). (2018). Bioaktive Brille: Materialien, Eigenschaften und Anwendungen (zweite Ausgabe). Elsevier. Aus Büchern erholt.Google.CO.gehen.
- Windholz, m. et al. (Herausgeber) (1983) Der Merck -Index. Eine Enzyklopädie von Chemikalien, Drarugs und Biologicals. Zehnte Ausgabe. Merck & co., Inc.
- Mäkinen, j. Und suni, t. (2015). Dickfilm Soi Wafers. In Handbook of Silicon -basierte MEMS -Materialien und -Technologien (zweite Ausgabe). Von Scientedirect erholt.com.
- Sirleto, l. et al. (2010). Thermo-optische Schalter. Siliziumnanokristalle. Von Scientedirect erholt.com.
- « Calciumfluorid (CAF2) -Struktur, Eigenschaften, verwendet
- 275 Pyropos für romantische und sexy Männer »

