Nicht -metallische Oxide

- 1214
- 243
- Medine Kedzierski
 Kohlendioxid ist ein Treibhausgas und auch ein nicht -metallisches Oxid
Kohlendioxid ist ein Treibhausgas und auch ein nicht -metallisches Oxid Was sind nicht -metallische Oxide?
Der Nicht -metallische Oxide Es handelt sich um binäre Verbindungen, die zwischen einem Nicht -Metall mit positivem Oxidationszustand und Sauerstoff mit Oxidationszustand -2 gebildet werden. Diese Verbindungen werden auch als Anhydride und Säuroxide bezeichnet. Sie neigen dazu, säurliche Lösungen zu bilden, indem sie sie in Wasser lösen.
Nicht metallische Oxide sind in der Natur sehr häufig. Tatsächlich sind sie überall. Wasser, die lebenswichtige Flüssigkeit, die zwei Drittel der Erdoberfläche abdeckt, ist ein nicht -metallisches Oxid. So sind Kohlendioxid, das wir während unserer Atem- und Schwefeloxide ausatmen, die Luft kontaminieren und sauren Regen verursachen.
Die Verbindungen, die ihre Atome vereinen, sind in den meisten polaren Fällen die Verbindungen, die ihre Atome vereinen, in den meisten polaren Fällen durch Nicht -Metalle und Sauerstoff gebildet (was auch nicht -Metal ist). Aus diesem Grund hat die überwiegende Mehrheit der nicht -metallischen oder anhydriden Oxide erheblich niedrige Siedepunkte, und viele von ihnen sind Gase bei Raumtemperatur.
Nicht -metallische Oxide Eigenschaften
- Sie haben keinen Glanz- oder metallischen Glanz.
- Sie können unterschiedliche Farben haben.
- Ihre Atome sind durch kovalente Bindungen anstelle von ionischen Verbindungen vereint.
- Sie werden durch Sauerstoff und ein Nicht -Metall gebildet.
- Im Vergleich zu Metalloxiden haben sie normalerweise niedrige Schmelz- und Siedepunkte, obwohl sie sehr unterschiedlich sind.
- Die meisten sind Gase, können aber auch im Festkörper gefunden werden (wie z. B. n2ENTWEDER3) oder Flüssigkeit bei Raumtemperatur.
- Feste nicht -metallische Oxide sind normalerweise spröde und können unterschiedliche Härte haben.
- Sie sind schlechte Leiter von Wärme und Strom.
- Wenn sie sie in Wasser auflösen, reagieren sie auf Oxazidsäuren.
- Einige seiner Oxazidsäuren sind starke Säuren, die dazu neigen, Anionen oder Oxyanionen in wässriger Lösung zu bilden.
- Sie reagieren mit basischen Oxiden, um Ochsensalze zu bilden.
Arten von nicht -metallischen Oxiden
Es gibt keine formale oder allgemein anerkannte Klassifizierung von nicht -metallischen Oxiden. Diese können jedoch nach ihren Säure-Base-Eigenschaften gruppiert werden.
Obwohl nicht -metallische Oxide auch Säureoxide genannt werden, reagieren nicht alle immer als Säuren gegen andere Verbindungen. In Anbetracht dessen können drei verschiedene Arten von nicht -metallischen Oxiden gemäß ihren Säure-/Baseneigenschaften identifiziert werden:
Nicht -Metallinsäureoxide
Sie sind die häufigsten. Die überwiegende Mehrheit der Verbindungen zwischen Sauerstoff und einem anderen Nicht -Metall, unabhängig von ihrem Oxidationsstatus, produziert Mineralsäuren beim Auflösen in Wasser und führt zu sauren Lösungen.
- Einige Beispiele für Säureoxide sind Stillanhydrid (N)2ENTWEDER5) und der Schwefelanhydrid (also3).
Neutrale nicht -metallische Oxide
Einige nicht -metallische Oxide reagieren bei der Auflösung überhaupt nicht mit Wasser. In diesen Fällen ist die resultierende Lösung neutral (sie ist weder sauer noch grundlegend).
- Einige Beispiele für neutrale Oxide sind Kohlenstoffmonoxid (CO), Lachoxid (N₂O) und Chlordioxid (CLO2).
Nicht metallische amphotoröse Oxide
Der Begriff Anfótero Es bezieht sich auf die Fähigkeit einer chemischen Verbindung, sich als Säure oder als Base zu verhalten, je nachdem, wer darauf reagiert. Das heißt, dies sind Verbindungen, die gleichzeitig sowohl Säuren als auch Basen sind.
- Unter den amphotischen nicht -metallischen Oxiden ist das häufigste Wasser (h2ENTWEDER). Das Wasser ist amphotent, da es einer Basis (als Säure wirkt) ein Proton geben kann, aber auch ein Proton einer Säure (als Basis fungiert) empfangen kann.
Beispiele für nicht -metallische Oxide
Die häufigsten nicht -metallischen Oxide jedes Nicht -Metalls sind nachstehend zusammen mit seiner molekularen Formel nach der systematischen Nomenklatur des IUPAC gemäß der Aktiennomenklatur und gemäß der traditionellen Nomenklatur dargestellt:
Kohlenstoffoxide
Formel | IUPAC -systematischer Name | Stock Nomenklatur | Traditioneller Name |
CO | Kohlenmonoxid | Kohlenstoffoxid (II) | Kohlenstoffanhydrid |
CO2 | Kohlendioxid | Kohlenstoffoxid (iv) | Kohlensäureanhydrid |
Stickoxide
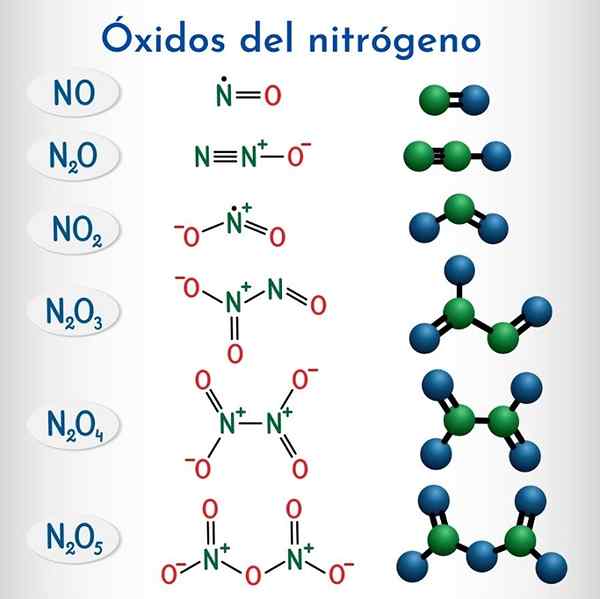 Formeln und Strukturen der 6 nicht -metallischen Stickoxide
Formeln und Strukturen der 6 nicht -metallischen Stickoxide Formel | IUPAC -systematischer Name | Stock Nomenklatur | Traditioneller Name |
N2O | Dinitrogenmonoxid | Stickstoffoxid (i) | Lachgas (Hiponitrosoanhydrid) |
NEIN | Stickstoffmonoxid | Stickstoffoxid (II) | Stickoxid |
N2O3 | Dinitrogen -Trioxid | Stickstoffoxid (III) | Nitrosanhydrid |
N2O4 | Dinitrogen -Tetraxid | Stickstoffoxid (IV) | Stickstofftetraxid |
NO2 | Stickstoffdioxid | Stickstoffoxid (IV) | Stickstoffdioxid |
N2O5 | Dinitrogenpentaoxid | Stickstoffoxid (V) | Anhydrid |
Phosphoroxide
Formel | IUPAC -systematischer Name | Stock Nomenklatur | Traditioneller Name |
P2O3 | Diphosphacking -Trioxid | Phosphoroxid (III) | Phosphoranhydrid |
P2O5 | Diphosphack Pentaoxid | Phosphoroxid (V) | Phosphoranhydrid |
P2O4 | Diphosphack -Tetraxid | Phosphoroxid (III, V) | --- |
Arsenoxide
Formel | IUPAC -systematischer Name | Stock Nomenklatur | Traditioneller Name |
As2o3 | Diarsen -Trioxid | Arsenoxid (III) | Arseniosoanhydrid |
As2o5 | Diarmsenpentaoxid | Arsenoxid (V) | Arsenanhydrid |
Antimonoxide
Formel | IUPAC -systematischer Name | Stock Nomenklatur | Traditioneller Name |
SB2O3 | Diantimony Trioxid | Antimonoxid (III) | Antimoner Anhydrid |
SB2O5 | Diantimony Pentaoxid | Antimonoxid (v) | Antimonischer Anhydrid |
Schwefeloxide
Formel | IUPAC -systematischer Name | Stock Nomenklatur | Traditioneller Name |
SW | Schwefelmonoxid | Schwefeloxid (II) | Hyposulfurousanhydrid |
SO2 | Schwefeldioxid | Schwefeloxid (iv) | Schwefelanhydrid |
SO3 | Schwefeltrioxid | Schwefeloxid (vi) | Schwefelanhydrid |
Selenoxide
Formel | IUPAC -systematischer Name | Stock Nomenklatur | Traditioneller Name |
SEO | Selenmonoxid | Selenoxid (II) | Hypiplololusanhydrid |
SEO2 | Seleniumdioxid | Selenoxid (IV) | Selenaranhydrid |
SEO3 | Seleniumtrioxid | Selenoxid (vi) | Selénischer Anhydrid |
Teluriooxide
Formel | IUPAC -systematischer Name | Stock Nomenklatur | Traditioneller Name |
Teo | Telurio Monoxid | Teluriooxid (II) | Hypelusanhydrid |
Teo2 | Telurio Dioxid | Teluriooxid (IV) | Telurusanhydrid |
Teo3 | Telurio -Trioxid | Teluriooxid (vi) | Telluranhydrid |
Chloroxide
Formel | IUPAC -systematischer Name | Stock Nomenklatur | Traditioneller Name |
Cl2o | Chlormonoxid | Chloroxid (i) | Hypoklous Anhydrid |
CL2O3 | Chlor -Trioxid | Chloroxid (III) | Chloranhydrid |
CL2O5 | Chlorpentaoxid | Chloroxid (v) | Chloranhydrid |
CL2O7 | Chlor -Heptoxid | Chloroxid (vii) | Perchloranhydrid |
Bromoxide
Formel | IUPAC -systematischer Name | Stock Nomenklatur | Traditioneller Name |
BR2O | Brommonoxid | Bromoxid (i) | Hipobromer Anhydrid |
BR2O3 | Brom -Trioxid | Bromoxid (III) | Bromes Anhydrid |
BR2O5 | Brom -Pentaoxid | Bromoxid (v) | Bromanhydrid |
BR2O7 | Brom Heptaoxid | Bromoxid (vii) | Perbromischer Anhydrid |
Jodoxide
Formel | IUPAC -systematischer Name | Stock Nomenklatur | Traditioneller Name |
I2o | Jodmonoxid | Jodoxid (i) | Hypoyodosoanhydrid |
I2o3 | Jod -Trioxid | Jodoxid (III) | Yodosoanhydrid |
I2o5 | Jodpentaoxid | Jodoxid (v) | Yodiumanhydrid |
I2o7 | Iod -Heptoxid | Jodoxid (vii) | Periódicoicanhydrid |

