Kalium -Yodato (KIO3)
- 844
- 166
- Joy Hort
Was ist Kaliumjodat?
Kalium- oder Kalium -Yodato -Yodato ist eine anorganische Jodverbindung, insbesondere ein Salz, dessen chemische Formel Kio ist3. Das Jod oder Jod, Element der Halogengruppe (F, Cl, Br, I, AS), hat in diesem Salz eine Oxidationszahl von +5; Deshalb ist es ein starkes Oxidationsmittel. Der Kio3 Es dissoziiert sich in wässrigem Medium, um die K -Ionen zu erzeugen+ und io3-.
Es wird synthetisiert, indem Kaliumhydroxid mit Yodiumsäure reagiert wird: HIO3(aq) + koh (s) => kio3(aq) + h2Oder (l). Außerdem kann es durch Reagieren von Molekularjod mit Kaliumhydroxid synthetisiert werden: 3i2(s)+6koh (s) => kio3(aq) + 5ki (aq) + 3h2Oder (l).
Kalium -Yodato -Eigenschaften
 Kalium -Yodato -Aussehen
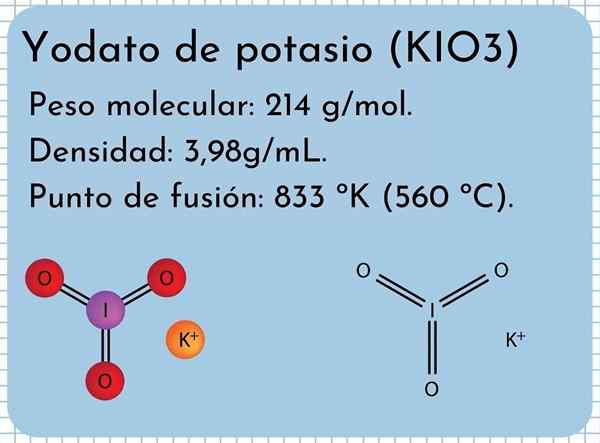
Kalium -Yodato -Aussehen Es ist ein geruchloser weißer fester, feiner Kristalle und mit einer monoklinen kristallinen Struktur. Es hat eine Dichte von 3,98 g/ml, ein Molekulargewicht von 214 g/Mol und zeigt Absorptionsbanden im Infrarotspektrum (IR).
Es hat einen Schmelzpunkt: 833 ºK (560 ºC), bestehend aus starken ionischen Wechselwirkungen zwischen K -Ionen+ und io3-. Bei höheren Temperaturen eine thermische Zersetzungsreaktion, die molekulare Sauerstoff- und Kaliumiodid freisetzt:
2kio3(s) => 2ki (s) + 3o2(G)
In Wasser hat es Lösungen, die von 4,74 g/100 ml bis 0 ° C, bis zu 32,3 g/100 ml bei 100 ° C variieren, wodurch farblose wässrige Lösungen erzeugt werden. Darüber hinaus ist es in Alkohol und Salpetersäure unlöslich, aber in verdünntem Schwefelsäure löslich.
Seine Affinität zu Wasser ist nicht nennenswert, was erklärt, warum es nicht hygroskopisch ist und in Form von hydratisierten Salzen (Kio nicht existiert3· H2ENTWEDER).
Oxidationsmittel
Kalium -Yodato hat, wie durch seine chemische Formel angezeigt, drei Sauerstoffatome. Dies ist ein stark elektronegatives Element, und aufgrund dieser Eigenschaft „entdeckt“ ein elektronischer Wolkenmangel „entdeckt“, der Jod umgibt.
Kann Ihnen dienen: InertgaseDieser Mangel - oder Beitrag, wie der Fall - kann als Oxidationszahl des Jods (± 1, +2, +3, +5, +7) berechnet werden, was bei diesem Salz +5 ist.
Was bedeutet das? Dass Jod vor einer Art, die ihre Elektronen geben kann, sie in ihrer ionischen Form akzeptiert (IO3-) molekulares Jod zu werden und eine Oxidationszahl gleich 0 zu haben.
Nach dieser Erklärung kann festgestellt werden, dass Kaliumjodat eine oxidierende Verbindung ist, die in vielen Redoxreaktionen intensiv mit reduzierenden Wirkstoffen reagiert. Von all diesen ist man als Joduhr bekannt.
Die Joduhr besteht aus einem Redoxprozess von langsamen und schnellen Schritten, bei dem die schnellen Schritte durch eine KIO -Lösung gekennzeichnet sind3 In Schwefelsäure, zu der Stärke zugesetzt wird. Dann, die Stärke, die er produziert und verankert wurde, die Art der Art I3-- Es wird die farbenfrohe blaue Lösung für dunkelblau machen.
Io3- - + 3 HSO3- - → i- - + 3 HSO4- -
Io3- - + 5 i- - + 6 h+ → 3 i2 + 3 h2ENTWEDER
Yo2 + HSO3- - + H2O → 2 i- - + HSO4- - + 2 h+ (Dunkelblau wegen der Stärke)
Chemische Struktur
 Kalium -Yodato -Struktur
Kalium -Yodato -Struktur Im überlegenen Bild wird die chemische Struktur des Kaliumjodats veranschaulicht. Der IO -Anion3- Es wird durch das "Stativ" von roten und lila Kugeln dargestellt, während die K -Ionen+ Sie werden durch lila Kugeln dargestellt.
Aber was bedeuten diese Stativen? Die korrekten geometrischen Formen dieser Anionen sind tatsächlich trigonale Pyramiden, bei denen der Sauerstoff die dreieckige Basis ausmacht, und das nicht stammende Drehmoment von Jod zeigt nach oben, besetzt den Raum und zwingt die I-O-Verbindung und die beiden Links i = o.
Kann Ihnen dienen: TartarsäureDiese molekulare Geometrie entspricht einer SP -Hybridisierung3 des zentralen Atoms von Jod; Eine andere Perspektive legt jedoch nahe, dass eines der Sauerstoffatome Verbindungen zu den Orbitalen "D" von Jod bildet, was tatsächlich eine Hybridisierung des SP -Typs ist3D2 (Jod kann seine "D" -Dorbitale seine Valencia -Schicht erweitern lassen).
Die Kristalle dieses Salzes können als Folge der unterschiedlichen physikalischen Bedingungen, die sie unterwerfen.
Verwendungen und Anwendungen von Kaliumjodat
Therapeutischer Gebrauch
Kalium -Yodato wird normalerweise verwendet, um die Ansammlung von Radioaktivität in der Schilddrüse in Form von zu vermeiden 131I, wenn dieses Isotop zur Bestimmung von Jod durch Schilddrüse als Bestandteil des Betriebs der Schilddrüse verwendet wird.
Ebenso wird Kalium -Yodato als topisches Antiseptikum (0,5 %) in Schleimhäuten verwendet.
Verwendung in der Industrie
Es wird dem Essen von Zuchttieren als Jodergänzung hinzugefügt. Daher wird in der Branche Kalium -Yodato verwendet, um die Qualität von Mehl zu verbessern.
Analytischer Verwendung
In der analytischen Chemie wird es dank seiner Stabilität als primäres Muster bei der Standardisierung von Natriumthiosulfatmustern verwendet (NA2S2ENTWEDER3) mit dem Zweck der Bestimmung der Jodkonzentrationen bei den Problemen mit Problemen.
Dies bedeutet, dass Jodmengen durch volumetrische Techniken (Grad) bekannt sein können. In dieser Reaktion oxidiert das Kaliumjodat schnell auf die Iodidionen i-, Durch die folgende chemische Gleichung:
Kann Ihnen dienen: Bleiacetat: Struktur, Eigenschaften, erhalten, verwendet, verwendetIo3- + 5i- + 6h+ => 3i2 + 3H2ENTWEDER
Das Jod, ich2, trägt den Titel mit der NA -Lösung2S2ENTWEDER3 für seine Standardisierung.
Verwendung in der Lasertechnologie
Studien haben die interessanten piezoelektrischen, pyroelektrischen, elektrooptischen, ferroelektrischen und nichtlinearen Optiken von Kio -Kristallen demonstriert und bestätigt3. Dies führt zu großen Potenzialen im elektronischen Bereich und in der Technologie der Laser für Materialien, die mit dieser Verbindung hergestellt wurden.
Gesundheitsrisiken von Kaliumjodat
In hohen Dosen kann es Reizungen in der Mundschleimhaut, Haut, Augen und Atemwege erzeugen.
Die Experimente der Toxizität des Kaliumjodats bei Tieren haben es uns ermöglicht zu beobachten.
Wenn diese Erbrechen vermieden werden, produziert es bei Tieren eine Verschlechterung ihrer Situation, da eine Magersucht und vor dem Tod induziert wird. Seine Autopsien durften nekrotische Leberläsionen, Nieren und Darmschleimhaut beobachten.
Aufgrund seiner oxidierenden Kraft stellt es ein Feuerrisiko dar, wenn es mit brennbaren Materialien in Kontakt kommt.
Verweise
- Tag, r., & Underwood, a. Quantitative analytische Chemie (Fünfter Aufl.). Pearson Prentice Hall, P-364.
- Chemikalbuch. (2017). Kaliumjodat. Abgerufen am 25. März 2018 aus Chemicalbook: Chemicalbook.com
- Pubchem. (2018). Kaliumjodat. Abgerufen am 25. März 2018 aus Pubchem: Pubchem.NCBI.NLM.NIH.Regierung
- Merck. (2018). Kalium -Yodato. Abgerufen am 25. März 2018 von Merck:
- Merckmillipore.com
- M M Abdel Kader et al. (2013). Ladungstransportmechanismus und Übergänge der niedrigen Temperaturphasen in Kio3. J. Phys.: Conf. Sei. 423 012036

