Geschichte Jod, Eigenschaften, Struktur, Erhalten, Risiken, verwendet

- 4973
- 806
- Joe Hartwig
Er Jod Es handelt. Im Wesentlichen ist es ein gut bekanntes Element auf der beliebten Ebene, vom iodierten Wasser bis zum Tyrosinhormon.
Im Festzustand ist das Jod dunkelgrau mit einem metallischen Glanz (unteres Bild), der in der Lage ist, einen violeten Dampf zu erzeugen, der beim Kondenseln auf einer kalten Oberfläche einen dunklen Rückstand hinterlässt. Zahlreiche und attraktiv waren Experimente, um diese Eigenschaften zu demonstrieren.
 Robuste Jodkristalle. Quelle: Bungee [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]
Robuste Jodkristalle. Quelle: Bungee [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]] Dieses Element wurde erstmals von Bernard Curtois im Jahr 1811 isoliert, während sie Verbindungen erhielt, die als Rohstoff für die Herstellung von Salpeter dienten. Curtois identifizierte Jod jedoch nicht als Element, das von Joseph Gay-Lussac und Humphry Davy geteilt wurde. Gay-Lussac identifizierte das Element als "iode", einen Begriff, der aus dem griechischen Wort "ioides" stammte, mit dem die violette Farbe bezeichnet wurde.
Das elementare Jod ist wie die anderen Halogene ein zweistiges Molekül, das von zwei Jodatomen gebildet wird, die durch eine kovalente Bindung vereint sind. Die Wechselwirkung von Van der Waals zwischen Iodmolekülen ist die stärkste unter Halogenen. Dies erklärt, warum Jod Halogen mit den höchsten Schmelzen- und Siedepunkten ist. Darüber hinaus ist es das geringste Reagenz der Halogene und das mit weniger Elektronegativität.
Jod ist ein wesentliches Element, das aufgenommen werden muss, da es für das Körperwachstum notwendig ist. Gehirn und geistige Entwicklung; Stoffwechsel im Allgemeinen usw., Empfehlung einer täglichen Einnahme von 110 µg/Tag.
Der Mangel des Jods im fetalen Zustand einer Person ist mit dem Auftreten eines Kretinismus verbunden, eine Erkrankung, die durch das Verlangsamen des Körperwachstums gekennzeichnet ist. sowie unzureichende geistige und intellektuelle Entwicklung, Strabismus usw. usw.
In der Zwischenzeit ist ein Jodmangel in jedem Alter des Individuums mit dem Auftreten eines Kropfs verbunden, der durch eine Schilddrüsenhypertrophie gekennzeichnet ist. Der Kropf ist eine endemische Krankheit, da er auf bestimmte geografische Gebiete mit eigenen Nahrungsmerkmalen beschränkt ist.
[TOC]
Geschichte
Entdeckung
Das Jod wurde vom französischen Chemiker Bernard Curtois im Jahr 1811 entdeckt, als er mit seinem Vater in der Produktion von Salitre zusammenarbeitete, und erforderte es von Natriumcarbonat.
Diese Verbindung wurde aus Seetang isoliert, die an der Küste der Normandie und der Bretagne gesammelt wurde. Zu diesem Zweck brannten die Algen und die Asche wurden mit Wasser gewaschen, was den resultierenden Abfall durch Zugabe von Schwefelsäure zerstörte.
Einmal aufgrund eines zufälligen Fehlers fügte Cottois einen Überschuss an Schwefelsäure hinzu, und es wurde ein lila Dampf gebildet, der auf kalten Oberflächen kristallisierte und als dunkle Kristalle abwies. Curtois vermutete, dass er in der Gegenwart eines neuen Elements war und ihn "Substanz X" nannte.
Curtois entdeckte, dass diese Substanz beim Mischen mit Ammoniak einen braunen Feststoff (Stickstoff Triacuro) bildete, der minimalen Kontakt ausnutzte.
Curtois hatte jedoch Einschränkungen, seine Forschung fortzusetzen, und beschloss, Charles Desormes, Nicolas Clément, Joseph Gay-Lussac und André-Marie Ampère Anzeichen seiner Substanz zu liefern, um seine Zusammenarbeit zu erhalten.
Entstehung des Namens
Im November 1813 machten Desormes und Clément die Entdeckung von Curtois öffentlich. Im dezember.
Sir Humphry Davy, der einen Teil der von Cottois an Ampère gelieferten Probe erhielt, experimierte mit der Probe und bemerkte eine Ähnlichkeit mit Chlor. Im Dezember 1813 nahm die Royal Society of London an der Identifizierung eines neuen Elements teil.
Obwohl ein Argument zwischen Gay-Lussac und Davy über die Identifizierung von Jod entstand. 1839 Curtois Finale.
Historische Verwendungen
Im Jahr 1839 gab Louis Daguerre dem Jod seinen ersten kommerziellen Einsatz, indem er eine Methode zur Herstellung fotografischer Bilder, die Daguerreotypes namens Daguerreotypes erzeugt, in dünnen Blättern von Metall erstellt haben.
1905 untersuchte der amerikanische Pathologe David Marine Jodmangel bei bestimmten Krankheiten und empfahl seine Aufnahme.
Physikalische und chemische Eigenschaften
Aussehen
 Sublimation von Jodkristallen. Quelle: Ershova Elizaveta [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]
Sublimation von Jodkristallen. Quelle: Ershova Elizaveta [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]] Dunkelgrau Metallic Gluster. Wenn es seine Dämpfe untermauert, sind sie violette Färbung (überlegenes Bild).
Standard Atomgewicht
126.904 u
Atomnummer (z)
53
Schmelzpunkt
113,7 ºC
Siedepunkt
184,3 ºC
Dichte
Umgebungstemperatur: 4.933 g/cm3
Löslichkeit
Im Wasser löst es sich auf, um braune Lösungen einer Konzentration von 0,03% bis 20 ° C zu verursachen.
Diese Löslichkeit steigt erheblich an- und ich2 Die anionische Spezies bilden i3-, das ist besser gelöst als Jod.
In organischen Lösungsmitteln wie Chloroform, Kohlenstofftetrachlorid und Kohlenstoffdisulfid löst sich Jod auf. Es löst sich auch in Stickstoffverbindungen wie Pyridin, Chinolin und Ammoniak, um wieder eine braune Lösung zu bilden.
Der Unterschied in den Farben liegt in der Tatsache, dass Jod als Solvatmoleküle I gelöst wird2, oder als Lastkomplexe; Letzteres erscheinen, wenn sie sich umgehen.
Kann Ihnen dienen: Natriumsulfid (Na2s)Geruch
Hektar, irritierend und charakteristisch. Geruchsschwelle: 90 mg/m3 und irritierende Geruchsschwelle: 20 mg/m3.
Oktanol/Wasserpartitionskoeffizient
Log p = 2,49
Zersetzung
Wenn er zur Zersetzung erhitzt wird, emittiert er einen Wasserstoff -Jodidrauch und mehrere Iodidverbindungen.
Schmiere
2,27 CP bei 116 ºC
Dreifacher Punkt
386,65 K und 121 kPa
Kritischer Punkt
819 K und 11,7 MPa
Fusionshitze
15,52 kJ/mol
Verdampfungswärme
41,57 kJ/mol
Molkalorienkapazität
54,44 j/(mol · k)
Dampfdruck
Das Jod hat einen mäßigen Dampfdruck und wenn der, der geöffnet ist.
Oxidationszahlen
Die Oxidationszahlen für Jod sind: -1 (i-), +1 (i+), +3 (i3+), +4 (i4+), +5 (i5+), +6 (i6+) und +7 (i7+). In allen Iodidsalzen, wie der Ki, trifft das Jod auf eine Oxidationszahl von -1, weil wir Anion I haben-.
Jod erwerbt positive Oxidationszahlen, wenn sie mit mehr elektronegativen Elementen in Kombination als er in Kombination ist. Zum Beispiel in ihren Oxiden (ich2ENTWEDER5 und ich4ENTWEDER9) oder interhalogenierte Verbindungen (I-F, I-CL und I-BR).
Elektronegativität
2.66 auf der Paulingskala
Ionisationsenergie
Erstens: 1.008.4 kJ/mol
Zweitens: 1.845 kJ/mol
Dritte: 3.180 kJ/mol
Wärmeleitfähigkeit
0,449 w/(m · k)
Elektrischer widerstand
1,39 · 107 Ω · m bis 0 ºC
Magnetische Ordnung
Diamagnetisch
Reaktivität
Jod wird mit den meisten Metallen kombiniert, um Iodide zu bilden, und auch mit nicht -metallischen Elementen wie Phosphor und anderen Halogenen. Das Iodid -Ion ist ein starkes Reduktionsmittel, das spontan ein Elektron freigibt. Die Iodidoxidation erzeugt einen bräunlichen Farbstoff Jod.
Jod im Gegenteil von Jodid ist ein schwaches Oxidationsmittel; schwächer als Brom, Chlor und Fluorid.
Das Jod mit Oxidationszahl +1 kann mit anderen Halogenen mit Oxidationszahl -1 kombiniert werden, um die Halogenide von Jod zu entstehen; Zum Beispiel: Jodbromid. Es wird auch mit Wasserstoff kombiniert, um Wasserstoffiodid zu verursachen, was nach dem Auflösen in Wasser iarhydinsäure bezeichnet wird.
Yodhorinsäure ist eine sehr starke Säure, die Iodide durch Reaktion mit Metallen oder ihren Oxiden, Hydroxiden und Carbonaten bilden kann. Jod hat einen Oxidationszustand +5 in Yodiumsäure (HIO3), der dehydriert wird, um Jodpentoxid zu produzieren (i2ENTWEDER5).
Elektronische Struktur und Konfiguration
- Jodatom und ihre Links
 Iod -Diatommolekül. Quelle: Benjah-BMM27 über Wikipedia.
Iod -Diatommolekül. Quelle: Benjah-BMM27 über Wikipedia. Das Jod in seinem basalen Zustand besteht aus einem Atom, das sieben Elektronen Valencia hat, nur eine davon, sein Oktett zu vervollständigen und mit edlem Xenongas isolektronisch zu werden. Diese sieben Elektronen sind in ihren 5S- und 5p -Orbitalen gemäß ihrer elektronischen Konfiguration angeordnet:
[Kr] 4d10 5s2 5 p5
Atome zeige ich daher eine starke Tendenz, kovalent zu verbinden, damit jeder einzeln acht Elektronen in seiner äußersten Schicht hat. Somit nähern ich mich zwei Atome, die ich mir den I-I-Link nähern und das Diatommolekül i definieren2 (überlegenes Bild); Molekulare Jodeinheit in seinen drei physikalischen Zuständen unter normalen Bedingungen.
Im Bild wird das Molekül I beobachtet2 dargestellt durch ein Raumfüllungsmodell. Es ist nicht nur ein diatomisches Molekül, sondern auch homonukleär und apolar; So seine intermolekularen Wechselwirkungen (ich2 - Yo2) Sie unterliegen den Londoner Dispersionskräften, die direkt proportional zu ihrer molekularen Masse und Atomgröße sind.
Diese I-I-Verbindung ist jedoch schwächer als die der anderen Halogene (F-F, CL-CL und Br-BR). Dies ist theoretisch auf die schlechte Überlappung seines SPO zurückzuführen3.
- Kristalle
Die molekulare Masse des i2 Es ermöglicht seine dispersiven Kräfte ausreichend richtungsreich und stark, um ein ortorrombisches Glas bei Umgebungsdruck zu etablieren. Der hohe Elektronengehalt fördert Licht -Übergangssymphine, die Jodkristalle erzeugen.
Wenn Jod jedoch untermauert, zeigen seine Dämpfe eine violette Färbung. Dies zeigt bereits einen spezifischeren Übergang innerhalb der molekularen Orbitale des i2 (Diejenigen mit größerer Energie oder Antienlace).
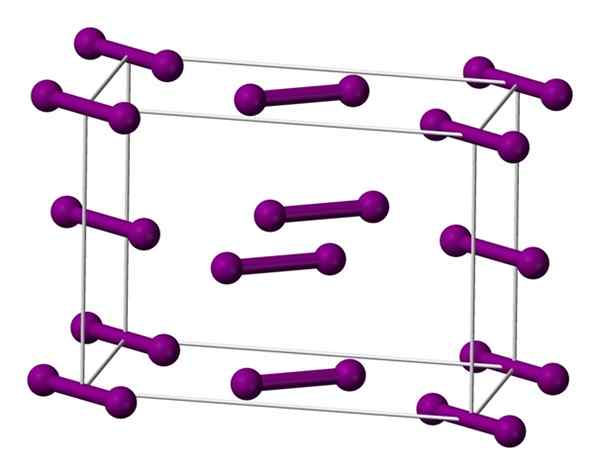 Einheitliche ortorrombische Zelle, die auf der Basis für Jodkristall zentriert ist. Quelle: Benjah-BMM27 [Public Domain].
Einheitliche ortorrombische Zelle, die auf der Basis für Jodkristall zentriert ist. Quelle: Benjah-BMM27 [Public Domain]. Die Moleküle, die ich oben gezeigt haben2, dargestellt durch ein Modell von Kugeln und Stäben, die in der ortorrombischen Zelle geordnet sind.
Es kann beobachtet werden, dass es zwei Schichten gibt: die der unten mit fünf Molekülen und das des Mediums mit vier. Beachten Sie, dass sich ein Jodmolekül an der Basis der Zelle befindet. Der Kristall wird regelmäßig diese Schichten in den drei Abmessungen konstruiert.
Es wird festgestellt, dass sich die Iod-Orbitale parallel zu den I-I-Links überlappen, um ein Fahrband zu erzeugen, das zu diesem Element einen Halbleiter zurückkehrt. Seine Fähigkeit, Strom zu leiten, verschwindet jedoch, wenn die Richtung senkrecht zu den Schichten befolgt wird.
Verbindungsentfernungen
Der I-I-Link scheint sich verzögert zu haben; Und in der Tat ist es, weil die Länge seiner Verbindung von 266 Uhr (Gasuszustand), 272 Uhr (Festkörper) steigt (Festkörper).
Dies kann darauf zurückzuführen sein, dass in Gas die Moleküle i2 Sie sind sehr distanziert, ihre intermolekularen Kräfte sind fast vernachlässigbar; Während diese Kräfte (i-i-i-i-i-i) im Festen greifbar werden und die Jodatome von zwei benachbarten Molekülen zu sich selbst und gemäß dem intermolekularen Abstand (oder interatomar, sonst gesehen) zu sich selbst und nach der intermolekularen Entfernung anziehen), ziehen sie an.
Es kann Ihnen dienen: Verhältnis der Chemie zu anderen WissenschaftenDann, wenn das sublimale Jodglas, die I-I-Anleihe in der Gasphase zusammenfasst, wie benachbarte Moleküle nicht mehr die gleiche Anziehungskraft (dispersiv) über seine Umgebung ausüben. Und logischerweise die Entfernung i2 - Yo2 erhöht sich.
- Phasen
Es wurde oben erwähnt, dass die I-I-Verbindung schwächer ist als die der anderen Halogene. In der Gasphase bei einer Temperatur von 575 ° C 1% der Moleküle I2 Sie zersetzen sich in Individuum und Atome. Es gibt so viel thermische Energie, dass nur zwei und Re -join getrennt sind und so weiter.
In ähnlicher Weise kann dieses Linkbruch auftreten, wenn große Drücke auf Jodkristallen angewendet werden. Wenn es zu viel Komprimieren (unter Druck hunderttausendmal höher als atmosphärisch), ist die Moleküle I2 Sie werden als monoatomische Phase I neu angeordnet, und es wird dann gesagt, dass Jod Metalleigenschaften aufweist.
Es gibt jedoch andere kristalline Phasen wie: Körper -zentriertes Ortrhrom.
Wo ist es und erhalten
Jod hat einen Gewichtsverhältnis in Bezug auf die Erdkruste, 0,46 ppm, und belegte den Platz 61 in ihrer Fülle darin. Yoduro -Mineralien sind knapp, und Jodeinlagen, die kommerziell ausnutzbar sind, sind Yodatos.
Jodmineralien finden in magmatischen Gesteinen mit einer Konzentration von 0,02 mg/kg bei 1,2 mg/kg und in magmatischen Gesteinen mit einer Konzentration von 0,02 mg bei 1,9 mg/kg. Es kann auch in der Kimmeridge Lutita mit einer Konzentration von 17 mg/kg Gewicht gefunden werden.
Darüber hinaus finden sich Iodmineralien in Phosphatgesteinen mit einer Konzentration zwischen 0,8 und 130 mg/kg. Meerwasser hat eine Jodkonzentration, die zwischen 0,1 und 18 µg/l variiert. Algen, Schwämme und Meeresaustern waren früher die Hauptjodquellen.
Die Hauptquellen sind jedoch Caliche, Natriumnitratablagerungen in der Atacama -Wüste (Chile) und der Salmuelas, hauptsächlich dem des japanischen Gasfelds in Minami Kanto, östlich von Tokio, und dem Anadarko -Gasfeldbecken in Oklahoma (USA ).
Die Caliche
Jod wird aus Iodinus caliche extrahiert und mit Natriumbisulfit behandelt, um es auf Iodid zu reduzieren. Dann reagiert die Lösung mit neu extrahierten Yodato, um ihre Filtration zu erleichtern. Die Caliche war die Hauptquelle für Jod im neunzehnten und frühen 20. Jahrhundert.
Die Salzlösung
Nach ihrer Reinigung wird die Salzlösung mit Schwefelsäure behandelt, die Jodid erzeugt.
Diese Iodidlösung reagiert anschließend mit Chlor, um eine verdünnte Jodlösung zu erzeugen, die durch einen Luftstrom verdampft, der zu einem absorbierenden Turm mit Schwefeldioxid abweichen wird, was die folgende Reaktion erzeugt:
Yo2 + 2 h2Oder +so2 => 2 hi +h2SW4
Anschließend reagiert Wasserstoff Iodidgas mit Chlor, um Jod in einem gasförmigen Zustand freizusetzen:
2 hi +cl2 => I2 + 2 HCl
Und schließlich Jodfilter, reinigt und Verpackung zur Verwendung.
Biologisches Papier
- Empfohlene Diät
Jod ist ein wesentliches Element, da es in zahlreichen Funktionen in Lebewesen interveniert, die besonders beim Menschen bekannt sind. Der einzige Weg zum Eintritt von Jod in den Menschen sind die Lebensmittel, die er aufnimmt.
Die empfohlene Joddiät variiert mit dem Alter. Somit benötigt ein 6 -monatiger Junge eine Aufnahme von 110 µg/Tag; Aber ab 14 Jahren beträgt die empfohlene Ernährung 150 µg/Tag. Darüber hinaus wird angemerkt, dass die Jodaufnahme 1 nicht überschreiten sollte.100 µg/Tag.
- Schilddrüsenhormone
Das Schilddrüsenstimulierhormon (TSH) wird von der Hypophyse sekretiert und stimuliert Jod mit Schilddrüsenfollikeln. Jod wird in den Schilddrüsenfollikeln getragen, die als Kolloiden bezeichnet werden, wo es an das Aminosäure -Tyrosin bindet, um Monoyodothyrosin und Diodothyrosin zu bilden.
Im follikulären Kolloid, ein Monoyodirosin3). Andererseits können zwei Diodotothyrosin -Moleküle verbunden werden, die Tetrarydotyron bilden (T4). Der t3 und T4 Sie sind die sogenannten Schilddrüsenhormone.
Hormone t3 und T4 Sie werden auf Plasma sekretiert, wo sie an Plasmaproteine bindet. Unter ihnen das Förderprotein der Schilddrüsenhormone (TBG). Die meisten Schilddrüsenhormone werden in Plasma als t transportiert4.
Die aktive Form der Schilddrüsenhormone ist jedoch t3, Also der t4 In den "weißen Organen" von Schilddrüsenhormonen, Erfahrungen und verwandelt sich in t3 Um Ihre hormonelle Handlung auszuüben.
Auswirkungen
Die Auswirkungen der Wirkung von Schilddrüsenhormonen sind vielfältig und können auf Folgendes hinweisen: Erhöhung des Stoffwechsels und Proteinsynthese; Förderung des Körperwachstums und der Entwicklung des Gehirns; Erhöhter Blutdruck und Herzfrequenz usw.
- Mangel
Der Mangel an Jod und daher von Schilddrüsenhormonen, die als Hypothyreose bezeichnet werden, hat zahlreiche Konsequenzen, die vom Alter der Person beeinflusst werden.
Wenn ein Jodmangel während des fetalen Zustands einer Person auftritt, ist die relevanteste Folge der Kreatinismus. Diese Erkrankung ist durch Anzeichen wie Verschlechterung der geistigen Funktion, Verzögerung der körperlichen Entwicklung, des Strudismus und der späten sexuellen Reifung gekennzeichnet.
Kann Ihnen dienen: Kupfer: Geschichte, Eigenschaften, Struktur, Verwendung, biologisches PapierEin Jodmangel kann einen Kropf induzieren, unabhängig von dem Alter, in dem Mangel auftritt. Ein Kropf ist eine übermäßige Entwicklung der Schilddrüse, die durch eine übermäßige Stimulation der Drüse durch das TSH -Hormon verursacht wird, die aus der Hypophyse als Folge eines Jodmangels aus der Hypophyse freigesetzt wird.
Die übermäßige Größe der Schilddrüse (Kropf) kann die Luftröhre komprimieren und den Luftweg durch sie beschränken. Darüber hinaus kann es die Kehlkopfnerven schädigen, die als Ergebnis Rum haben können.
Risiken
Eine Vergiftung aufgrund einer übermäßigen Jodaufnahme kann Verbrennungen im Mund, im Hals und im Fieber verursachen. Auch Bauchschmerzen, Übelkeit, Erbrechen, Durchfall, schwacher Puls und Koma.
Ein Überschuss an Jod erzeugt einige der bei einem Mangel beobachteten Symptome: Es gibt eine Hemmung der Synthese von Schilddrüsenhormonen, sodass die Freisetzung von TSH zunimmt, was zu einer Schilddrüsenhypertrophie führt. Das heißt, ein Kropf.
Es gibt Studien, die darauf hinweisen, dass eine übermäßige Jodaufnahme Schilddrüsenpapillärkrebs verursachen kann. Darüber hinaus kann eine übermäßige Jodaufnahme mit Medikamenten interagieren, indem er seine Wirkung begrenzt.
Übermäßige Jodaufnahme mit Antithyreoid -Medikamenten wie Metimazol, die zur Behandlung von Hyperthyreose eingesetzt wird, kann eine additive Wirkung haben und Hypothyreose verursachen.
Angiotensin (ECA), die Enzyminhibitoren wie Benazepril umwandeln, wird bei der Behandlung von Bluthochdruck verwendet. Eine übermäßige Menge an Kaliumiodid erhöht das Risiko für Hyperkaliämie und Bluthochdruck.
Anwendungen
Ärzte
Jod wirkt als Desinfektionsmittel von Haut oder Wunden. Es hat fast ein Schnappschuss antimikrobiell, durchdringt die Mikroorganismen und interagiert mit Schwefelaminosäuren, Nucleotiden und Fettsäuren, die den Zelltod verursachen.
Es übt seine antivirale Wirkung grundlegend auf die abgedeckten Viren aus und postuliert, die die Oberfläche der abgedeckten Viren angreift.
Kaliumiodid in konzentrierter Lösung wird zur Behandlung von Thyrotoxikose verwendet. Es wird auch verwendet, um die Auswirkungen einer Strahlung von zu kontrollieren 131Ich blockiere die Vereinigung des radioaktiven Isotops auf die Schilddrüse.
Jod wird zur Behandlung von dendritischer Keratitis verwendet. Dazu ist die Hornhaut zu Dampf von gesättigten Wasser mit Jod freigelegt, das Epithel der Hornhaut verliert vorübergehend; Aber es gibt eine vollständige Wiederherstellung in zwei oder drei Tagen.
Jod hat auch vorteilhafte Auswirkungen auf die Behandlung der menschlichen Sinusfibrose. Ebenso wurde darauf hingewiesen, dass die 131Ich könnte eine optionale Behandlung mit Schilddrüsenkrebs sein.
Reaktionen und katalytische Wirkung
Jod wird verwendet, um das Vorhandensein von Stärke zu erkennen und eine blaue Färbung zu verleihen. Die Reaktion des Jods mit Stärke wird auch verwendet, um das Vorhandensein von Falsch -Tickets zu erkennen, die auf Papier gedruckt sind, die Stärke enthalten.
Kalium (II) Tetrayodomercurat, auch als Nessler -Reagenz bekannt, wird beim Ammoniaknachweis verwendet. Ebenso wird im Iodoformtest eine alkalische Jodlösung verwendet, um das Vorhandensein von Methylcetonous zu zeigen.
Anorganisches Jodid. In einer Phase des Prozesses müssen Tetrayoduros dieser Metalle gebildet werden.
Jod dient als Stabilisator für Kolfonien, Öl und andere Holzprodukte.
Jod wird als Katalysator bei organischen Synthesereaktionen von Methylierung, Isomerisierung und Dehydrierung verwendet. In der Zwischenzeit wird Iarchlorsäure als Katalysator für die Herstellung von Essigsäure in den Monsanto- und Cativa -Prozessen verwendet.
Jod wirkt als Katalysator in der Kondensation und Alposition von aromatischen Aminen sowie bei Sulfatisierungs- und Sulfanationsprozessen sowie für die Produktion von synthetischen Gummi.
Fotografie und Optik
Silver Yoduro ist ein wesentlicher Bestandteil des traditionellen fotografischen Films. Jod wird zur Herstellung elektronischer Instrumente wie einzigartiger Glasprismen, polarisierenden optischen Instrumenten und einem Glas verwendet, das Infrarotstrahlen übertragen kann.
Andere Verwendungen
Jod wird zur Ausarbeitung von Farbstoffen Pestizide, Anilin und Phtaleía verwendet. Darüber hinaus wird es in der Farbstoffsynthese verwendet und ist ein Rauchlöschmittel. Und schließlich dient Silver Iodid als Kern der Kondensation von Wasserdampf in den Wolken, um Regen zu verursachen.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Stuart Ira Fox. (2003). Menschliche Physiologie. Erste Ausgabe. Bearbeiten. McGraw-Hill Inter-American
- Wikipedia. (2019). Jod. Abgerufen von: in.Wikipedia.Org
- Takemura Kenichi, Sato Kyoko, Fujihisa Hiroshi & Onoda Mitsuko. (2003). Modulierter Stadel von festem Jod während der STI -Molekulardissoziation und und. Nature Band 423, Seiten971-974. doi.org/10.1038/nature01724
- Chen l. et al. (1994). Strukturphasenübergänge von Jod bei hohem Druck. Institut für Physik, Sinica Academy, Peking. doi.org/10.1088/0256-307X/11/2/010
- Stefan Schneider & Karl Christen. (26. August 2019). Jod. Encyclopædia Britannica. Erholt von: Britannica.com
- DR. Doug Stewart. (2019). Iodelement -Fakten. Chemicool. Erholt von: Chemicoolool.com
- Nationales Zentrum für Biotechnologie Information. (2019). Jod. Pubchem -Datenbank. CID = 807. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Rohner, f., Zimmermann, m., Joost, p., Pandav, c., Caldwell, k., Raghavan, r., & Raiten, D. J. (2014). Biomarker der Ernährung für die Entwicklung der Entwicklungsidentechnik. Das Journal of Nutrition, 144 (8), 1322S-1342s. Doi: 10.3945/jn.113.181974
- Advameg. (2019). Jod. Chemie erklärt. Erholt von: ChemistryExplaed.com
- Traci Pedersen. (19. April 2017). Fakten über Jod. Erholt von: Livescience.com
- Megan Ware, rdn, ld. (30. Mai 2017). Alles, was Sie über Jod wissen müssen. Erholt von: MedicalNewstody.com
- Nationales Gesundheitsinstitut. (9. Juli 2019). Jod. Abgerufen von: SDG.Od.NIH.Regierung
- « Kripton Geschichte, Eigenschaften, Struktur, erhalten, Risiken, verwendet
- Mary Celeste Vorgänger, Ereignisse, Theorien »

