Blei -Iodid -Struktur, Eigenschaften, erhalten, verwendet, verwendet

- 4601
- 1191
- Joe Hartwig
Er Jodid führen Es ist eine anorganische Verbindung, die durch das Bleielement (PB) in seiner Oxidation +2 und Jod (i) mit Valencia -1 gebildet wird. Seine chemische Formel ist das BIP2. Es ist eine giftige Verbindung. Weil es führend ist, ist für Menschen, Tiere und natürliche Ökosysteme schädlich. Darüber hinaus kann Jodid auch einige Krankheiten verursachen.
Die BIP -Verbindung4, Dies scheint, mit Blei in Oxidation +4, es scheint, dass es nicht existiert, wahrscheinlich aufgrund der reduzierenden Kapazität des Jodid -Ions (ich-). Das BIP2 Es ist eine durch solide gelbe Farbe, die in Wasser wenig löslich ist.
 Bleijodid (BIP2) solide. W. Oelen/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/3.0). Quelle: Wikimedia Commons.
Bleijodid (BIP2) solide. W. Oelen/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/3.0). Quelle: Wikimedia Commons. Es kann unter Verwendung einer Ionenaustauschreaktion zwischen einem Jodidsalz und einer Blei erhalten werden, die beide in Wasser löslich sind.
Es verfügt über Halbleitereigenschaften, sodass die meisten seiner aktuellen Anwendungen in Photovoltaik -Geräten, Detektoren bestimmter Strahlung und Sensoren enthalten sind.
Eine der am häufigsten untersuchten Verwendungen dieser Verbindung ist die von Perovskita -Solarzellen, die sich als sehr effizient und niedrig erwiesen haben.
[TOC]
Struktur
Im Bleijodid ist die Vereinigung zwischen ihren Atomen nur teilweise ionisch. Atome bilden Schichten mit sechseckiger Struktur und sie sind durch schwache Kräfte von Van der Waals miteinander verbunden.
Diese Kräfte sind weder ionisch noch kovalent, sind schwache Wechselwirkungen zwischen den elektronischen Atomenschichten.
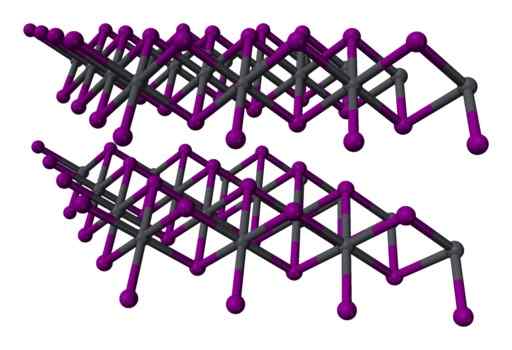 Zwei -Layer -Drei -Layer -Struktur2 kristallin. Grau = Blei; Violet = Jod. Benjah-BMM27 / Public Domain. Quelle: Wikimedia Commons.
Zwei -Layer -Drei -Layer -Struktur2 kristallin. Grau = Blei; Violet = Jod. Benjah-BMM27 / Public Domain. Quelle: Wikimedia Commons. Nomenklatur
- Jodid führen
- Bleijodid (ii)
- Lead Diyoduro
- Plumboso Iodid
Eigenschaften
Körperlicher Status
Hellgelb kristalline Feststoff. Sechskantkristalle.
 Hexagonale Kristalle des Bleijodids. Alessandro e Damiano/CC von (https: // creativecommons.Org/lizenzen/bis/4.0). Quelle: Wikimedia Commons.
Hexagonale Kristalle des Bleijodids. Alessandro e Damiano/CC von (https: // creativecommons.Org/lizenzen/bis/4.0). Quelle: Wikimedia Commons. Molekulargewicht
461 g/mol
Schmelzpunkt
410 ºC
Siedepunkt
954 ° C, mit Zersetzung kochen.
Dichte
6,16 g/cm3
Löslichkeit
Leicht wasserlöslich: 0,076 g/100 ml bei 25 ° C. Heißes Wasser löslich. Unlöslich in Alkohol und kaltes Salzsäure (HCL).
Kann Ihnen dienen: Natrium: Geschichte, Struktur, Eigenschaften, Risiken und VerwendungChemische Eigenschaften
Die oxidierenden und reduzierenden Eigenschaften sind schwach. Sie können jedoch Oxidenuktionsreaktionen vorstellen.
Obwohl es sehr wenig löslich ist, löst sich in Wasser in konzentrierten Lösungen von alkalischen Iodden wie Kaliumiodid (KI) auf. Es ist löslich in einer konzentrierten Lösung von Natriumacetat (CH3Tasche). Es löst sich frei in Natrium -Thiosulfat -Lösung (NA2S2ENTWEDER3).
Einige Autoren geben an, dass das Ion PBI im Wasser erzeugt werden kann+ Und wenn es überschüssiges Ion gibt (ich-) komplexere Arten wie das BIP können gebildet werden3- und BIP42-, unter anderem.
Es ist nicht brennbar.
Andere physikalische Eigenschaften
Es verhält sich wie ein Halbleiter, dh es kann Elektrizität leiten oder nicht, abhängig von den Bedingungen, denen es ausgesetzt ist.
Es ist ein direkter Gap -Halbleiter, dh, wenn eines seiner Elektronen vom Valencia -Band zum Fahren gelangen, darf es nur eine Menge Energie haben, die der verbotenen Bandbreite entspricht.
Aufgrund der hohen Atomzahl seiner Elemente (PB = 82, i = 53) hat es eine hohe photoelektrische Kapazität. Das 2,5 -Gap -Band ermöglicht eine hohe Photovoltaik -Leistungen mit hohem Effizienz bei Temperaturen von bis zu 250 ° C.
Erhalten
Es kann hergestellt werden, indem eine wasserlösliche Verbindung mit iarhydinsäure (HI) oder mit einem löslichen Metalljodid reagiert wird. Zum Beispiel ist eine wässrige Lösung von Bleiacetat mit Kaliumiodid gemischt:
PB (ch3Gurren)2 + 2 ki → BIP2↓ + 2 K (wählen Sie3Gurren)
Diese Art von Reaktion wird als "Ionenaustausch" bezeichnet, weil Kationen und Anionen zwischen Salzen ausgetauscht werden.
In dem genannten Beispiel ist Kaliumacetat in Wasser sehr löslich und bleibt gelöst, während Kaliumiodid weniger löslich ist, ausfällt und Filter. Die Reinigung erfolgt durch Rekristallisierung der Verbindung in Wasser.
Kann Ihnen dienen: KristallisationPBI -Niederschlag2 Es ist im folgenden Bild zu sehen, das ein Testrohr zeigt, in dem Bleinitrat (ii) (pb (nein3)2) und Kaliumiodid (KI) in wässriger Lösung. Dieser Effekt heißt "Gold of Gold".
 Goldregen vom BIP2. Stefano SCT/CC BY-S (https: // CreePecommons.Org/lizenzen/by-sa/4.0). Quelle: Wikimedia Commons.
Goldregen vom BIP2. Stefano SCT/CC BY-S (https: // CreePecommons.Org/lizenzen/by-sa/4.0). Quelle: Wikimedia Commons. Anwendungen
Als Halbleiter
Es wird als Detektor für Photonen mit hoher Energy wie X -Strahlen und Gammastrahlen verwendet. Es kann in Photovoltaik -Geräten, Photozellen, LED -Leuchten, optischen Detektoren sowie in biologischer Klassifizierung und Sensoren verwendet werden.
Wenn Sie in Nanostrukturen eingeführt werden, kann es in Photokatalyse und Solarzellen verwendet werden. Darüber hinaus viele BIP -Nanopartikel2 Sie haben lumineszierende Eigenschaften.
 Bleijodid wird in X -Ray -medizinischen Detektoren verwendet. Autor: lkcjjang40090. Quelle: Pixabay.
Bleijodid wird in X -Ray -medizinischen Detektoren verwendet. Autor: lkcjjang40090. Quelle: Pixabay. Solarzellen
Das BIP2 Es ist ein Vermittler in der Synthese von Perovskitas, die für Solarzellen bestimmt sind. Diese Art von Photovoltaikzellen enthält Methylammonium und Bleijodid (wählen Sie3NH3BIP3) Auf der Grundlage von Onkel2.
Solche Geräte haben eine hohe Effizienz und niedrige Kosten, daher waren sie viel Studie und Forschung.
 Solarzellen auf dem Dach eines Hauses im Feld. Die Solarzellen, in denen PBI verwendet wird2 Sie sind sehr effizient und nicht sehr teuer, daher könnten sie in Zukunft in Häusern eingesetzt werden. Autor: Manfred Antranias Zimmer. Quelle: Pixabay.
Solarzellen auf dem Dach eines Hauses im Feld. Die Solarzellen, in denen PBI verwendet wird2 Sie sind sehr effizient und nicht sehr teuer, daher könnten sie in Zukunft in Häusern eingesetzt werden. Autor: Manfred Antranias Zimmer. Quelle: Pixabay. Aber seit Cho3NH3BIP3 Es kann mit Regenwasser zusammenbrechen. Es wurde untersucht.
Das CH3NH3BIP3 Nach dem Kontakt mit Wasser bricht es in Methylamin ein (wählen Sie3NH2), Yodhydsäure und BIP2. Letztere, obwohl es in Wasser wenig löslich ist, kann im Laufe der Zeit Mengen aus dem giftigen Ion PB freisetzen2+.
Die Studien sind nicht schlüssig, da der Ort, an dem Bleifreisetzung stattfindet, um festzustellen, ob die Menge kurzfristig schädlich sein kann. Auf der anderen Seite kann eine fortgesetzte Freigabe bioakkumuliert und sehr gefährlich sein.
Kann Ihnen dienen: Butanone: Struktur, Eigenschaften und VerwendungAndere Apps
- Es wird in Form von Sprüh in den Wolken gesät, um Regen zu produzieren.
- In Filtern zur Astronomie des entfernten Infrarots.
- In Fotografie, Eindrücken, Filme zum Aufnehmen optischer Bilder, fotografische Emulsionen.
- In der Bremsbeschichtung. In Schmierfetten.
- Quecksilber -Dampfbogenlampen. Auf elektrischem Papier.
- Thermoelektrische Materialien, Wärmebatterien mit Jod.
Risiken
Für Sicherheit
Es muss weit weg von Oxidationsmitteln wie Peroxiden, Peroxiden, Permanganaten, Chlorise und Nitraten gelagert werden. Kontakt mit chemisch aktiven Metallen wie Kalium, Natrium, Magnesium und Zink sollten ebenfalls vermieden werden. In all diesen Fällen kann eine heftige Reaktion auftreten.
Wenn Sie sich erhitzen, werden giftige Gase von Blei und Jod erzeugt.
Für die Gesundheit
Ist sehr schädlich für den Menschen. Es wurde bestätigt, dass es Karzinogen für Tiere ist. Daher ist es vernünftigerweise abgeleitet, dass es auch für den Menschen ist.
Es kann Kopfschmerzen, Reizbarkeit verursachen, den Gedächtnis reduzieren und den Schlaf stören. In dieser Verbindung enthaltene Blei kann dauerhafte Schäden an Nieren, Gehirn, Nerven, Blutzellen und Hochdruckrisiken erzeugen.
Es muss als Teratogen behandelt werden (Verbindung, die einen angeborenen Defekt erzeugen kann). Es kann auch Jodismus erzeugen, dessen Symptome die Stauung von Nasenlöchern, Kopfschmerzen, Reizung von Schleimhäuten und Hautausbrüchen unter anderem sind.
Für die natürliche Umwelt
Es wird als giftiger Schadstoff eingestuft. Es muss von Wasser ferngehalten werden und Quellen abtropfen. Um zu vermeiden, dass kontaminierende Deiche gebaut werden sollten, wenn es notwendig ist, es zu behalten.
Es ist sehr giftig für das Wasserleben mit Effekten, die im Laufe der Zeit dauern, da es bioakumulierbar ist.
Verweise
- Blei, d.R. (Herausgeber) (2003). CRC -Handbuch für Chemie und Physik. 85th CRC Press.
- ODER.S. Nationalbibliothek für Medizin. (2019). Jodid führen. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- Evstropiev; S.K. et al. (2020). Synthese und Charakterisierung von PVP/PBI2. Adv Compos Hybrid Mater 3, 49-57 (2020). Link wiederhergestellt.Springer.com.
- Ismail, r.ZU. et al. (2016). Synthese von PBI2 Nanopartikel durch Laserablation in Methanol. J Mater Sci: Mater Electron 27, 10696-10700 (2016). Link wiederhergestellt.Springer.com.
- Materialien. (2013). Bleijodid (BIP2) Halbleiter. Von Azom geborgen.com.
- CDH (2008). Blei (ii) Jodid. Sicherheitsdatenblattmaterial. Von chdfinechemical erholt.com.
- Hailegnaw, geb. et al. (2015). Regen auf Perowskiten auf Blei -Blei -Blei -Bleibasis: Mögliche Umwelteffekte von Perovskit -Solarzellen. J. Phys. Chem. Lette. 2015, 6, 9, 1543-1547. Aus Pubs geborgen.ACS.Org.
- Wikimedia Foundation (2020). Blei (ii) Jodid. Abgerufen von.Wikipedia.Org.
- « Bleiacetatstruktur, Eigenschaften, erhalten, verwendet, verwendet
- Organisation eines objektiven Unternehmens, Struktur, Beispiel »

