Kaliumiodid (KI) -Struktur, Eigenschaften, erhalten, verwendet, Risiken

- 1813
- 415
- Ivan Pressler
Er Kaliumjodid Es ist eine anorganische Verbindung, die durch ein Kaliumion (k) gebildet wird (k)+) und ein Jodidion (ich-). Seine chemische Formel ist Ki. Es ist ein weißer kristalline Feststoff der ionischen Natur und ist in Wasser sehr löslich.
Der KI ermöglicht mehrere chemische Reaktionen und Analysen und wird verwendet, um die Ozonmenge in der Atmosphäre zu messen. Es wird auch in Infrarot -Analyseausrüstung (IR) verwendet.
 Festes Ki -Kaliumjodid. Ondřej Manggl [Public Domain]. Quelle: Wikimedia Commons.
Festes Ki -Kaliumjodid. Ondřej Manggl [Public Domain]. Quelle: Wikimedia Commons. Kaliumiodid wird zum gemeinsamen Tischsalz hinzugefügt, um einen Jodmangel bei Menschen zu verhindern, da dies ein schwerwiegendes Gesundheitsproblem darstellen kann.
Es wird als Expektorant verwendet, da es hilft. Es dient auch dazu, einige Pilzinfektionen zu behandeln und wird in einigen Kosmetika verwendet.
Es wird von Tierärzten verwendet, um Tiere mit Problemen wie Menschen wie Husten und Hautinfektionen zu heilen. Es wird sogar in sehr kleinen Mengen zu Tieren für Tiere hinzugefügt.
[TOC]
Struktur
Kaliumiodid ist eine ionische Verbindung, die durch das Kaliumkation K gebildet wird+ Und der Yoduro I Anion-, Daher ist die Verbindung zwischen ihnen ionisch. Der Kaliumoxidationsstatus beträgt +1 und Valencia del Iod ist -1.
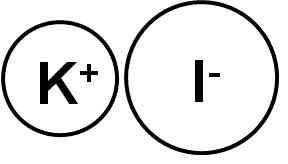 Kaliumiodid ist eine ionische Verbindung. Autor: Marilú Stea.
Kaliumiodid ist eine ionische Verbindung. Autor: Marilú Stea. Ki Kaliumjodidkristalle sind kubisch.
 Struktur eines Ki -Kaliumjodids. Benjah-BMM27 [Public Domain]. Quelle: Wikimedia Commons.
Struktur eines Ki -Kaliumjodids. Benjah-BMM27 [Public Domain]. Quelle: Wikimedia Commons. Nomenklatur
- Kaliumjodid
- Kaliumjodid
Eigenschaften
Körperlicher Status
Kristalliner weißer Feststoff. Kubikkristalle.
Molekulargewicht
166.003 g/mol
Schmelzpunkt
681 ºC
Siedepunkt
1323 ºC
Dichte
3,13 g/cm3
Löslichkeit
Sehr löslich in Wasser: 149 g/100 g Wasser bei 25 ° C. Etwas löslich in Ethanol und Äther.
Kann Ihnen dienen: Neon: Geschichte, Eigenschaften, Struktur, Risiken, verwendetpH
Seine wässrigen Lösungen sind neutral oder alkalisch, mit pH zwischen 7 und 9.
Chemische Eigenschaften
Leicht hygroskopisch in feuchter Luft.
Es ist stabil in trockener Luft. Licht und Luftfeuchtigkeit beschleunigen seine Zersetzung und seine Farbänderungen aufgrund der Freisetzung kleiner Mengen Jod (ich2) und Yodatos (io3-).
Ki wässrige Lösungen werden im Laufe der Zeit auch gelb, aber mit ein wenig Alkali kann dies vermieden werden.
Diese Lösungen lösen sich auf Jod (ich2) Ki geben3:
Yo- + Yo2 → i3-
Andere Eigenschaften
Es hat einen stark bitteren und salzhaltigen Geschmack. Es ist nicht brennbar.
Erhalten
Kaliumiodid kann durch Erhitzen von Jod (ich2) In einer konzentrierten Lösung von Kaliumhydroxid (KOH):
3 i2 + 6 Koh → 5 ki + kio3 + H2ENTWEDER
Die resultierende Yodato- und Iodid -Lösung wird erhitzt, um Wasser zu eliminieren. Sie wird auf Trockenheit reduziert, Kohle wird zugegeben und bei hoher Temperatur erhitzt. Kohle nimmt den Sauerstoff aus Iodat und oxidiert Kohlendioxid und reduziert so Jodid auf Iodid:
2 Kio3 + C → 2 ki + 3 co2
Das erhaltene Kaliumiodid kann reflektiert werden, um es zu reinigen. Das heißt, es wird in Wasser wiederentdeckt und führt dazu, dass es wieder kristallisiert wird.
Anwendungen
Bei der Behandlung von Hyperthyreose
Kaliumiodid dient als zusätzliche Behandlung zusammen mit anderen Antithyroid -Wirkstoffen zur Behandlung von Hyperthyreose.
Hyperthyreose ist eine Krankheit, die dazu führt.
 Frau mit entzündeter Schilddrüse. Es kann mit Ki Kaliumiodid behandelt werden. https: // www.Myupchar.com/in [cc by-sa (https: // creativeCommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons.
Frau mit entzündeter Schilddrüse. Es kann mit Ki Kaliumiodid behandelt werden. https: // www.Myupchar.com/in [cc by-sa (https: // creativeCommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons. Bei Patienten mit Hyperthyreose verringert Ki schnell die Symptome, da es die Freisetzung von Schilddrüsenhormon hemmt.
Seine Schilddrüseneffekte sind: verringert die Menge der Blutgefäße der Drüse, bestätigt ihr Gewebe und verringerte die Größe ihrer Zellen.
Aus diesem Grund gilt es als präoperative Behandlung, um die Involution oder Abnahme der Schilddrüsengröße vor der Thyreoidektomie (Schilddrüsenentfernung) zu induzieren, da dieser Vorgang erleichtert wird.
Kann Ihnen dienen: Natrium: Geschichte, Struktur, Eigenschaften, Risiken und VerwendungIn anderen medizinischen Anwendungen
Kaliumiodid hat expektorante Eigenschaften, wenn die Sekretion von Atemflüssigkeiten zunimmt, was zu einer verringerten Schleimviskosität führt.
 Kaliumiodid kann als Expektorant bei der Hustenbehaltung wirken. Autor: анастаball ге Seiten. Quelle: Pixabay.
Kaliumiodid kann als Expektorant bei der Hustenbehaltung wirken. Autor: анастаball ге Seiten. Quelle: Pixabay. Es dient zur Behandlung von Nodoso erythem, bei dem es sich um eine schmerzhafte Entzündung in den Beinen handelt, in denen rötete Knötchen und eine erhöhte Temperatur gebildet werden.
Ist ein Antihongos -Mittel. Es ermöglicht die Behandlung von Sporotrose, die eine Hautinfektion ist, die durch einen Pilz verursacht wird. Diese Krankheit entspricht Menschen, die mit Pflanzen und Land arbeiten, wie Bauern und Gärtnern.
Es wird auch bei der Behandlung von Jodmangel oder um diese zu vermeiden und somit zum Tischsalz oder essbares Salz (Natriumchlorid -NaCl) als Jodquelle und manchmal in Wasser zum Trinken zu erweitern.
In Tierärzten
Kaliumiodid wird an Tiere als kantig, um die Flüssigkeiten der Atemwege zu erhöhen und zu verflüssigen.
Es dient auch für Mykose (Pilzinfektionen) von Tieren, die Juckreiz und für chronische Blei oder Quecksilbervergiftung.
Im Schutz der Schilddrüse in radioaktiven Notfällen
Kaliumiodid hat Schilddrüsenschutzeigenschaften, falls die Person Kernstrahlung ausgesetzt war.
Der KI überflutet die Schilddrüse mit nicht -radioaktivem Jod und blockiert so die Einnahme radioaktiver Moleküle und die Absorption von radioaktivem Jod, wodurch die Schilddrüse vor Krebs geschützt wird, die Strahlung verursachen können.
In Ozonmaßen in der Atmosphäre
Ozongas (oder3) Es kann in der Atmosphäre unter Verwendung von Elektrolytzellen bezeichnet werden, die als Ozonosandas bezeichnet werden und von Radiosondas -Luftballons transportiert werden.
Kann Ihnen dienen: Benchilo BenzoateDiese Elektrolytzellen enthalten eine KI -Kaliumjodidlösung. Die Zellen sind anfangs im chemischen und elektrischen Gleichgewicht stehen.
Wenn eine Luftprobe mit Ozon (oder3) Eindringt in eine der Zellen. Das Gleichgewicht ist gebrochen, da die folgende Reaktion auftritt:
2 ki + oder3 + H2O → i2 + ENTWEDER2 + 2 Koh
Diese Reaktion erzeugt einen elektrischen Strom, der zwischen den Zellen fließt.
Die Menge des produzierten Stromstroms wird kontinuierlich durch Funkwellen auf einen Station an Land übertragen. Auf diese Weise wird das Ozonprofil vom Boden bis zur Höhe des Balls erhalten.
 Ballon nehmen mit Radiosonda mit KI, um Ozon zu messen. Hannes Grobe 19:27, 20. Juni 2007 (UTC), Alfred Wegener Institute für Polar- und Meeresforschung, Bremerhaven, Deutschland [CC BY-SA (https: // creativeCommons.Org/lizenzen/by-sa/2.5)]]. Quelle: Wikimedia Commons.
Ballon nehmen mit Radiosonda mit KI, um Ozon zu messen. Hannes Grobe 19:27, 20. Juni 2007 (UTC), Alfred Wegener Institute für Polar- und Meeresforschung, Bremerhaven, Deutschland [CC BY-SA (https: // creativeCommons.Org/lizenzen/by-sa/2.5)]]. Quelle: Wikimedia Commons. In mehreren Verwendungen
Kaliumiodid erlaubt auch:
- Die Eliminierung von freien Radikalen wie Hydroxylradikal OH.
- Die Herstellung von fotografischen Emulsionen, um Silber auszufällen.
- Verbesserung des Tierfutters, wenn sie in Mikrokontitäten hinzugefügt werden.
- Rinderdünger deodorisieren.
- Übertragen Sie das Infrarot -Spektrum -Licht in IR -Analysegeräten.
- Führen Sie bestimmte chemische Reaktionen und Analysen in Chemielabors durch.
- Verwenden Sie es in persönlichen Hygieneprodukten.
- Führen Sie die Analyse der Umweltverschmutzung durch.
Risiken
Manche Menschen, die für Jodid empfindlich sind.
Menschen mit Tuberkulose oder akuter Bronchitis sollten ebenfalls vorsichtig sein.
Der KI kann die Abschwächung der Speicheldrüsen verursachen, den Mund oder den Hals verbrennen, eine ungewöhnliche Zunahme des Speichels, Zahnschmerzen und Entzündungen des Zahnfleischs und des metallischen Geschmacks, unter anderem Symptome.
Sie können auch die Augen reizen und Wunden auf der Haut öffnen.
Verweise
- ODER.S. Nationalbibliothek für Medizin. (2019). Kaliumjodid. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Kirk-Othmer (1994). Enzyklopädie der chemischen Technologie. Vierte Edition. John Wiley & Söhne.
- Dean, J.ZU. (Editor). (1973). Langes Handbuch der Chemie. Elementh Edition. McGraw-Hill Book Company.
- Valkovic, v. (2019). Dekontamination nach Strahlungsbelastung. Die empfindlichsten Körperteile. In der Radioaktivität in der Umwelt (zweite Ausgabe). Von Scientedirect erholt.com.
- Schmied.G.J. (2015). Chemie der Atmosphärenbeobachtungen für die Chemie (in situ). In Encyclopedia of Atmospheric Sciences (zweite Ausgabe). Von Scientedirect erholt.com.
- Muralikrishna, ich.V. und Manickam, v. (2017). Analytische Methoden zur Überwachung der Umweltverschiebung. Im Umweltmanagement. Von Scientedirect erholt.com.
- Wallace, J.M. und Hobbs, p.V. (2006). Atmosphärische Chemie 1. In atmosphärischer Wissenschaft (zweite Ausgabe). Von Scientedirect erholt.com.
- « Änderungen der Zustandstypen und ihrer Merkmale (mit Beispielen)
- Dekantierungskonzept, Beispiele und Typen »

