Yoduro aber Eigenschaften, Struktur, Funktionen
- 4919
- 447
- René Riediger
Der Yoduro Peroxidase oder Schilddrüsenperoxidase (TPO) ist ein Hämo-Glykoprotein zur Familie der Säugetierperoxidasen (wie Myeloperoxidase, Lactoperoxidase und andere), die am Weg der Synthese des Schilddrüsenhormons beteiligt sind.
Seine Hauptfunktion ist die „Jodinierung“ von Tyrosinabfällen in Thyoglobulin und die Bildung des 3-3'-5-Triiodothyronin (T3) und des Thyroxin (T4) durch eine „Kopplung“ -Reaktion intramolekular von iodisierten Tyrosins.
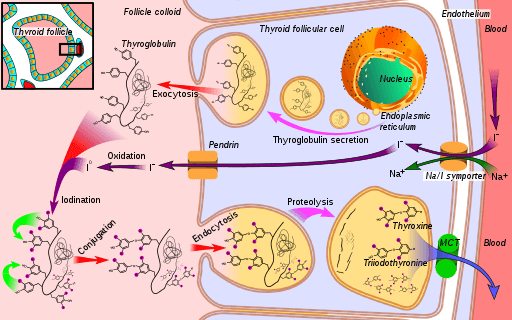
 Schema des Biosynthesewegs des Schilddrüsenhormons, wo die Iodidperoxidase (bei der Oxidation des Iodids zu Jod) (Quelle: Mikael Häggström [CC0] über Wikimedia Commons)
Schema des Biosynthesewegs des Schilddrüsenhormons, wo die Iodidperoxidase (bei der Oxidation des Iodids zu Jod) (Quelle: Mikael Häggström [CC0] über Wikimedia Commons) Triiodonin und Thyroxin sind zwei Hormone, die von der Schilddrüse produziert werden, die wesentliche Funktionen in der Entwicklung, Differenzierung und Stoffwechsel von Säugetieren haben. Sein Wirkungsmechanismus hängt von der Wechselwirkung seiner Kernrezeptoren mit spezifischen Gensequenzen seiner weißen Gene ab.
Die Existenz des Yoduro -Peroxidase -Enzyms wurde in den 1960er Jahren von verschiedenen Autoren bestätigt, und derzeit wurden erhebliche Fortschritte hinsichtlich der Bestimmung seiner Struktur, seiner Funktionen und der Eigenschaften des Gens erzielt, das es in verschiedenen Organismen kodiert,.
In weiten Teilen der Literatur zu diesem Enzym ist dies als mikrosomales "Autoantigen" bekannt und hängt mit einigen Schilddrüsen -Autoimmunerkrankungen zusammen.
Dank seiner immunogenen Eigenschaften ist dieses Enzym ein weißes oder Zielmolekül.
[TOC]
Eigenschaften
Das Peroxidase -Iodid wird durch ein Gen auf Chromosom 2 von Menschen kodiert, das mehr als 150 kpb misst und aus 17 Exons und 16 Introns besteht.
Dieses transmembraale Protein mit einem einzelnen Segment in der Membran ist eng mit Myeloperoxidase verwandt, mit der es mehr als 40% der Ähnlichkeit der Aminosäuresequenz teilt.
Kann Ihnen dienen: Acylglyceride: Eigenschaften, Struktur, Typen, FunktionenSeine Synthese tritt in Polyribosomen auf (Satz von Ribosomen, die für die Translation desselben Proteins verantwortlich sind) und wird dann in die endoplasmatische Retikulummembran eingefügt, wo sie einen Glykosylierungsprozess durchläuft.
Einmal synthetisiert und glykosyliert, wird Peroxidase -Iodid zum apikalen Pol des Zuges (Schilddrüsenzellen oder Schilddrüsenzellen) transportiert, wo es in der Lage ist, sein katalytisches Zentrum in Richtung des follikulären Lumen der Schilddrüse freizulegen.
Expressionsregulation
Die Expression des kodierenden Gens der Schilddrüsen- oder Iodidperoxidase wird durch spezifische Schilddrüsentranskriptionsfaktoren wie TTF-1, TTF-2 und PAX-8 gesteuert.
Die genetischen Elemente, die es ermöglichen, die Expression dieses Gens beim Menschen zu erhöhen oder zu verbessern, wurden in den Regionen beschrieben, die das Ende 5 'desselben flankieren, normalerweise zu den ersten 140 Basispaaren dieser Region "Flanqueant".
Es gibt auch Elemente, die die Expression dieses Proteins unterdrücken oder verringern, aber im Gegensatz zu den "Potentiatoren" wurden diese stromabwärts der Gensequenz beschrieben.
Ein Großteil der Regulation der genetischen Expression von Iodidperoxidase tritt auf gewebespezifische Weise auf Cis, wie Transkriptionsfaktoren TTF-1 und andere.
Struktur
Dieses Protein mit enzymatischer Aktivität hat etwa 933 Aminosäureabfälle und ein extrazelluläres C-terminales Ende von 197 Aminosäuren, die aus der Expression anderer Genmodule stammen, die für andere Glykoproteine kodieren.
Sein Molekulargewicht beträgt etwa 110 kDa und ist Teil der glykosylierten transmembranalen Proteingruppe vom Typ 1, da es ein glykosyliertes transmembranales Segment und eine HEMO -Gruppe an seinem aktiven aktiven Ort aufweist.
Es kann Ihnen dienen: Drüsen: Typ, Funktion, Entzündung und KrankheitenDie Struktur dieses Proteins hat zumindest eine Disulfidbrücke in der extrazellulären Region, die eine charakteristische geschlossene Schleife bildet, die auf der Oberfläche der Tirozyten freigelegt ist.
Funktionen
Die wichtigste physiologische Funktion des Peroxidase -Iodids hängt mit der Teilnahme an der Synthese des Schilddrüsenhormons zusammen, wo es die „Jodierung“ von Tyrosinabfällen von Monoyodothyrosin (MIT) und Dioseyrosin (DIT) zusätzlich zur Kopplung des Jodirlosins des Mausrosisins katalysiert. Rückstände in Thyoglobulin.
Was ist die Synthese des Schilddrüsenhormons?
Um die Funktion des Schilddrüsenperoxidase -Enzyms zu verstehen, müssen die Schritte der hormonellen Synthese berücksichtigt werden, an der es teilnimmt:
1-wahr mit dem Transport von Jodid in die Schilddrüse und setzt sich mit fort
2-die Erzeugung eines Oxidationsmittels wie Wasserstoffperoxid (H2O2)
3-posterior ein empfangendes Protein wird synthetisiert, Thyoglobulin
4-Yoduro wird zu einem Zustand älterer Valencia und danach oxidiert
5-Yoduro ist mit Tyrosinabfällen verbunden, die in Thyoglobulin vorhanden sind
6-in-Thyoglobulin, Iodothye (eine Art von Schilddrüsenhormonen) werden aufgrund einer ryodothischen Abfallkopplung gebildet
7-Der Thyoglobulin wird dann gespeichert und gespuckt
8-the iodirosinas iodirosinas wird entfernt und endlich,
9-Thyroxin wird freigesetzt und Triiodothyron in Richtung Blut; Diese Hormone üben ihre Wirkungen durch Wechselwirkung mit ihren spezifischen Rezeptoren aus, die sich in der Kernmembran befinden und in der Lage sind, mit weißen DNA -Sequenzen zu interagieren, was als Transkriptionsfaktoren fungiert.
Wie das Wissen über die Funktionen der beiden Hormone, deren Synthese beteiligt (T3 und T4).
Das Fehlen beider Hormone während der menschlichen Entwicklung erzeugt Defekte in Bezug auf Wachstum und geistige Behinderung sowie metabolische Ungleichgewichte im Erwachsenenleben.
Kann Ihnen dienen: Holoenzym: Eigenschaften, Funktionen und BeispieleVerwandte Krankheiten
Peroxidase -Iodid ist eines der wichtigsten Schilddrüsen -Autoantigene beim Menschen und ist mit der Zytotoxizität verwandt, die durch das Komplementsystem vermittelt wird. Seine Funktion als Autoantigen zeichnet sich bei Patienten mit Schilddrüsen -Autoimmunerkrankungen aus.
Gota -Krankheit beispielsweise ist auf einen Mangel an Jodgehalt während der hormonellen Synthese in der Schilddrüse zurückzuführen, die mit einem Thyroglobulin -Iodinierungsmangel mit bestimmten Defekten in bestimmten Defekten in der Peroxidase -Peroxidase verbunden ist.
Einige Karzinome sind durch veränderte Funktionen von Peroxidase -Iodid gekennzeichnet, dh die Aktivitätsniveaus dieses Enzyms sind signifikant niedriger als bei Nichtkrebs -Patienten.
Studien haben jedoch bestätigt, dass es sich um ein äußerst variables Merkmal handelt, was nicht nur vom Patienten, sondern auch von der Art des Krebses und den betroffenen Regionen abhängt.
Verweise
- DeGroot, l. J., & Niepomniszcze, h. (1977). Biosynthese des Schilddrüsenhormons: Grund- und klinische Aspekte. Fortschritte in der Endokrinologie und in den Stoffwechsel, 26(6), 665-718.
- Fragu, p., & Nataf, b. M. (1976). Menschliche Schilddrüsenperoxidaseaktivität bei gutartigen und bösartigen Schilddrüsenerkrankungen. Die endokrine Gesellschaft, Vier fünf(5), 1089-1096.
- Kimura, s., & Ikeda-saito, m. (1988). Humane Myeloperoxidae und Schilddrüsenperoxidase, zwei Enzyme mit getrennten und unterschiedlichen physiologischen Funktionen, sind evolutionäre Mitglieder derselben Gen -Genfamilie. Proteine: Struktur, Funktion und Bioinformatik, 3, 113-120.
- Nagasaka, a., Hidaka, h., & Ishizuki, und. (1975). Studien zu menschlichen Iodidperoxidase: seine Aktivität bei verschiedenen Schilddrüsenerkrankungen. Chemische Klinik, 62, 1-4.
- Ruf, J., & Carayon, p. (2006). Strukturelle und funktionelle Aspekte der Schilddrüsenperoxidase. Archiv für Biochemie und Biophysik, 445, 269-277.
- Ruf, J., Toubert, m., Czarnocka, geb., Durand-Gorde, m., Ferrand, m., & Carayon, p. (2015). Beziehung zwischen immunologischer Struktur und biochemischen Eigenschaften der menschlichen Schilddrüsenperoxidase. Endokrine Bewertungen, 125(3), 1211-1218.
- Taurog, a. (1999). Molekulare Entwicklung der Schilddrüsenperoxidase. Biochimie, 81, 557-562.
- Zhang, j., & Lazar, m. ZU. (2000). Der Wirkungsmechanismus von Schilddrüsenhormonen. Annu. Rev. Physiol., 62(1), 439-466.

